2月12日,博瑞生物发布了公告,公司称已经批量生产出瑞德西韦原料药,瑞德西韦制剂批量化生产正在进行中。
继之前“专利之争”后,瑞德西韦再次成为新闻焦点。
2月12日,博瑞生物医药(苏州)股份有限公司(以下简称“博瑞生物”)发布了公告,公告称,积极响应国家抗击新型冠状病毒(2019-nCoV)疫情的号召,于近日成功仿制开发了瑞德西韦原料药合成工艺技术和制剂技术。公司已经批量生产出瑞德西韦原料药,瑞德西韦制剂批量化生产正在进行中。
随后,博瑞医药董秘王征野表示,“我们今天已经开始生产制剂了,大概一周左右时间,第一批制剂就可以生产出来。我们不会发国难财,主要是把这种药品提供给国家,去救治病人。”
什么时候能上市?
根据公告,如果该药要上市,有几个门槛需要跨越:
1、目前博瑞生物只是仿制出原料药,制剂批量化生产还在进行中。而完成制剂研发,也至少要做一些药学方面的研究,比如稳定性试验等。
2、完成制剂研发后,需经过药物临床试验、药品审批等多个环节。
3、吉利德的专利是绕不过去,若博瑞生物的瑞德西韦最终转化为产品投入市场,需要获得Gilead公司作为专利权人的授权;
这倒不是说,怀疑我们国家药企的技术和国家应急审批能力,在疫情面前,我们有多种手段,可以缩短时间,提前上市,惠及患者。
但是,专利的障碍,短期无法逾越。
一是,吉利德原研厂都还在3期临床试验,如果有效,最快上市的也是吉利德,因为疫情紧急,时间不等人,即使价格高一些,也不得不用。
二是,吉利德原研产品未上市,自己都还没有收回研发投资,因此不太可能提前将专利授权。
因此,该药即使已经仿制成功,但是离正式上市,前面的路途还是很多未知数,远水解决不了近渴。
但是,不能说仿制就没有意义。
提前仿制的意义
虽然,疫情当前,近期上市可能性不大,远水解决不了近渴,但是该药的仿制,还是有很积极的意义:
1、该仿制药的研发是以响应国家号召,储备战略技术为目的。如果瑞德西韦临床试验有效,则可以有效地解决:吉利德的产能不足或者吉利德价格偏高等问题。
如果我们可以掌握核心技术,从而增强了我们国家的谈判筹码。则可以避免吉利德价格的飞涨。
如果国家实施了该药品专利的强制许可,瑞德西韦作为一种技术储备,也可以在重大情况面前独当一面。
关于药品专利的“强制许可”,我国已有相关的法律规定:
《专利法》第四十九条规定,在国家出现紧急状态或者非常情况时,或者为了公共利益的目的,国务院专利行政部门可以给予实施发明专利或者实用新型专利的强制许可。
《专利法》第五十条规定,为了公共健康目的,对取得专利权的药品,国务院专利行政部门可以制造并将其出口到符合中华人民共和国参加的有关国际条约规定的国家或者强制地区的强制许可。
但是,“强制许可”至今没有使用过。
2、秀肌肉, 博瑞生物为上市公司,公告称“凭借在高端原料药和特殊注射剂开发领域的技术积累”,有利于资本市场。
3、获得吉利德专利许可,通过正常审批通道,正常上市,也不是没可能。
4、吉利德将博瑞生物列为“瑞德西韦”原料药供应商,这种合作也是有可能的。因为之前吉利德的声明,都提到了要解决产能和原料药供应问题。
5、增加了企业的曝光度,免费的广告。
同时,博瑞生物也强调“公司将对瑞德西韦的仿制研发视为自身所承担的社会责任,若该产品能够获批上市,疫情期间主要通过捐赠等方式供应给相关病人。”
临床进展
被按谐音叫作“人民的希望”的抗病毒药物瑞德西韦(Remdesivir),2月6日已经武汉金银潭等一线医院开启临床试验。
瑞德西韦的制造商吉利德已进一步明确表态:研究药物的提供,全免费。
2月6日,首位受药的是一位68岁的男性重症患者。
方案曾多次调整
此前,按计划,试验将从2月3日开始,总样本量270例,入组轻、中度新冠肺炎患者。
2月5日,据瑞德西韦临床试验项目负责人、中日友好医院副院长曹彬教授介绍,按计划,该试验将入组轻、中症患者308例,重症患者453例,总计拟入组761例患者,采用随机、双盲、安慰剂对照方法展开。
整个临床试验于4月底结束,由于是双盲,所以医生、患者都不知道用的是安慰剂还是药品,只有揭盲的时候,才知道结果。
网上流传的瑞德西韦临床试验用药品
“对瑞德西韦抱有比较大的希望”
2月5日,王辰院士回答白岩松提问时回应称:“根据前期的结果,我们对瑞德西韦抱有比较大的希望,其他药物,包括中药,我们都需要进一步的临床观察来确定其疗效。特别提醒大家的是,个例的药品有效与否不是科学结论,一定要进行临床实验。”
中国科学院武汉病毒研究所/生物安全大科学研究中心与军事科学院军事医学研究院国家应急防控药物工程技术研究中心开展的联合研究,表明在抑制2019新型冠状病毒(2019-nCoV)药物筛选方面取得了重要进展。研究发现在Vero E6细胞上,瑞德西韦(Remdesivir, GS-5734)和氯喹(Chloroquine)在细胞水平上能有效抑制新型冠状病毒的感染,其在人体上的作用还有待临床实验。
瑞德西韦(半数有效浓度EC50 = 0.77μM ; 半细胞毒性浓度CC 50 > 100μM; 选择指数SI> 129.87)
在低微摩尔浓度下有效地阻断了病毒感染,并显示出较高的选择指数SI。
1月31号,权威医学期刊《新英格兰医学杂志》(NEJM)在线发表了多篇关于新型冠状病毒(2019-nCoV)病例的论文,其中一篇介绍了美国首例确诊病例的诊疗过程以及临床表现。
这篇论文引发了大众关注,因为有一种药物起到了立竿见影的疗效:病人于住院第7天晚上开始使用药物Remdesivir(雷德西韦),次日退烧(体温从头一天的39.4摄氏度降低到次日的37.3摄氏度),症状明显减轻!
美国的第一例患者,是个华人,于1月15日从武汉回到美国,两天后开始发烧,在1月20号确诊住院,住院后用了不少药物,但是一直不见效果,还是发烧。在住院第七天的晚上,使用了Remdesivir (瑞德西韦)的药(同情给药),结果第二天就退烧了,各种症状都在好转,到1月30号,患者只有咳嗽的症状,而且日渐轻微。
据 CNN 报道,目前该例患者已经出院。
瑞德西韦为第二代“利巴韦林”
公开资料显示,利巴韦林又名病毒唑,1986年被批准用于临床,是一种广谱抗病毒药物,由于对呼吸道合胞病毒(RSV)具有抑制作用,其主要被用于呼吸道合胞病毒引起的病毒性肺炎与支气管炎,曾是2003年抗击非典期间的明星药。
魏毅博士:瑞德西韦其实是第二代的“利巴韦林”,他们的作用机制是相同的,从结构上来看,瑞德西韦更加稳定,推测其作用也更强,剂量应该更小,体内分布更加理想。而高剂量的利巴韦林理论上也应该有效。
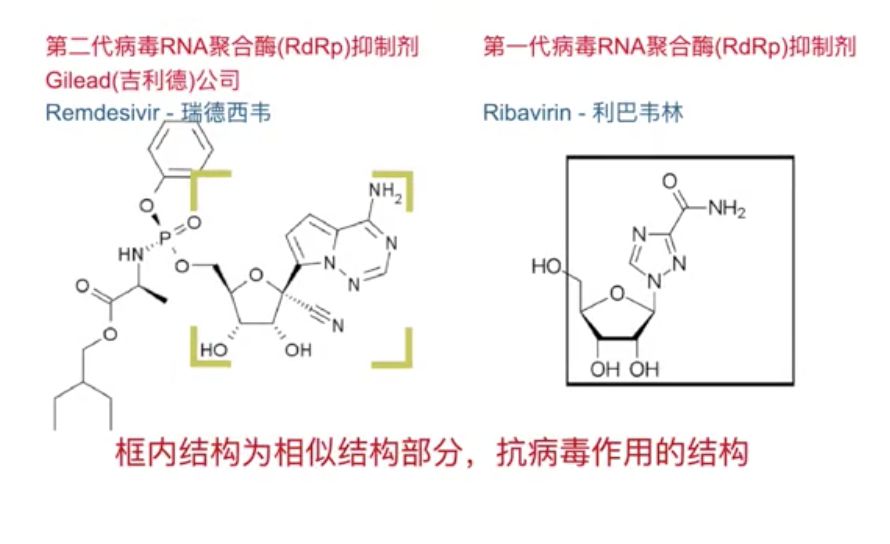
二者结构式“母核”相似
专利之争
吉利德CEO回应瑞德西韦专利之争:会保护专利但不会卷入纷争,患者第一。
在武汉病毒所公开声明申报了抗病毒药物Remdesivir的专利后,吉利德科学的全球CEO Daniel O’Day在2月5日的一场公司会议中回应了这场旋涡中的“专利之争”。
对于有人问到武汉病毒所申报Remdesivir专利,吉利德会怎么做时,Daniel O’Day表示,
“专利并不是眼下我们首要关心的问题。我问过负责专利的同事,就像吉利德的其他药物一样,我们已经为Remdesivir在全球各个地区申请了化合物、使用专利包括冠状病毒。我们不会卷入这个专利的问题,我们会找到方法来帮助患者,当然我们也会以另外的办法保护我们的知识产权,但是患者是第一位的。”
中国科学报在访问相关知情人士透露:专利申请本来就是“跑马圈地”,是在保护自己的利益。目前临床试验正在进行,不管试验结果是否证明瑞德西韦有效,我们都要申请这个专利。
最后,期待“人民的希望”瑞德西韦在临床上有良好的表现,不要让人民的希望破灭。
关于滴度
Drugdu滴度平台——全球跨境医贸的B2B电子商务平台。为您提供靠谱的医药、器械外贸知识,助力您的产品出海走世界。加小滴微信Drugdu2了解更多医贸知识。
责编: editor相关News
- 【专家速答】药品注册的分类注册管理是什么样的? 2023-07-27
- 滴度周报 | FDA批准新冠疫苗“混打”增强接种方案;国家卫健委发布《“十四五”国家临床专科能力建设规划》 2021-10-26
- 滴度周报 | 国家卫健委最新通知:完善国家传染病医学中心设置;葡萄糖注射液等42个药品被注销 2021-06-21
- 疫情当前,医贸人如何与国外客户沟通? 2021-05-16
- 滴度周报 | 康希诺:13价肺炎球菌多糖结合疫苗进入Ⅲ期临床试验;国务院:网售处方药全面放开 2021-04-19

 1,830
1,830







