海昶生物TLR9激动剂HC016脂质复合物注射液完成I期首例患者入组并获得FDA孤儿药资格认定
2026-01-14
来源: drugdu
 96
96

近日,浙江海昶生物医药股份有限公司自主研发的创新型肿瘤免疫治疗产品HC016脂质复合物注射液(以下简称“HC016”)取得两项重要进展:其一,该产品于2025年12月31日获得美国食品药品监督管理局(FDA)授予的孤儿药资格认定(ODD),用于治疗骨肉瘤。其二,该产品的I期临床研究已于2026年1月5日成功完成首例受试者入组,并于次日顺利完成首次给药。
HC016简介
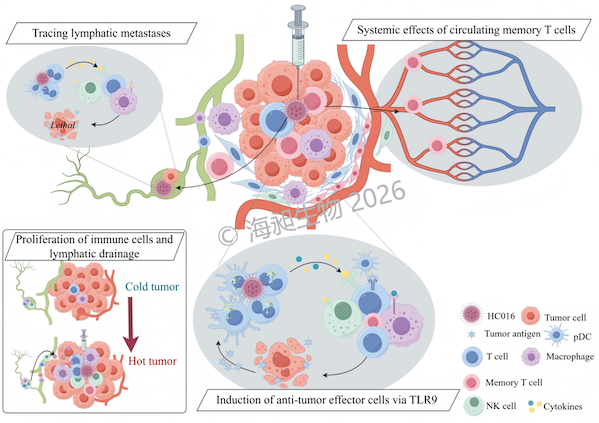
HC016是一款由海昶生物自主研发的Toll样受体9(TLR9)激动剂。该产品创新性地采用QTsomeTM脂质纳米颗粒(LNP)技术包封新型C型胞苷磷酸鸟苷寡脱氧核苷酸(CpG-ODN)产品,并通过瘤内注射直接递送至肿瘤部位。该递送技术不仅可以激活TLR9和下游信号通路,产生针对肿瘤的特异性免疫反应,而且能够显著减少全身药物暴露,提高治疗安全性,具有治疗广谱恶性肿瘤的潜力。
 © 海昶生物 2026,版权所有,未经授权禁止商用
© 海昶生物 2026,版权所有,未经授权禁止商用
HC016骨肉瘤适应症获美国FDA孤儿药资格认定
骨肉瘤(OS)是儿童和青少年最常见的原发性恶性骨肿瘤,其特征是恶性细胞产生类骨质或未成熟骨组织[1]。美国每年约有1000例新发OS确诊病例[2],被美国国家罕见病组织(NORD)正式认定为罕见病[3]。对于发生转移的患者,现有疗法效果有限,预后较差,五年生存率仅为20%-30%[4],存在迫切的临床未满足需求。
2025年12月31日,HC016顺利获得了美国食品药品监督管理局(FDA)孤儿药资格认定(ODD),用于骨肉瘤适应症。因HC016 递交资料充分、数据扎实,FDA在审评期内未提出任何信息请求(IR)授予批准,证明了海昶生物在罕见病药物开发领域严谨的科学态度、卓越的研发效率以及高标准的全球注册能力。此外,获得孤儿药认定是HC016开发过程中的关键里程碑,将为该药物的后续临床开发提供重要的政策支持,加速其惠及全球患者的进程。
HC016的I期临床研究首例受试者入组
2026年1月5日,HC016 的I期临床研究(CTR20254445)已完成首例受试者入组,并于1月6日顺利完成首次给药。I期临床研究分为剂量递增阶段和剂量扩展阶段,旨在评估HC016在晚期或复发性实体瘤(包括黑色素瘤,头颈鳞状细胞癌和肉瘤)患者中的安全性、耐受性、药代动力学特征、药效学特征和初步疗效。
https://bydrug.pharmcube.com/news/detail/b413eb9907ea37e87b840d8330602d11
相关News
- 2026年,中国抗肿瘤新药迎来「爆发之年」:15款重磅品种全透视 2026-02-28
- 复宏汉霖帕妥珠单抗生物类似药HLX11获欧洲药品管理局人用药品委员会积极意见 2026-02-28
- 康方生物自免管线再迎里程碑!曼多奇单抗申报上市,剑指百亿市场 2026-02-28
- 21亿美元!诺和诺德达成新合作 2026-02-28
- 礼来、诺和诺德之后,谁最具“减肥三哥”之像? 2026-02-28





