刀尖上行走的临床设计!聊聊ADC的安全窗口
2023-04-30
来源: drugdu
 4,155
4,155
BiG生物创新社
以下文章来源于新药说 ,作者sponge X
ADC也好,化药也好,总说“肿瘤的临床往往都是在刀尖上走”,这个刀尖就是指的临床上安全窗口(Therapeutic window)太小,我们看数据的时候,也总能看到“产品的安全窗口比阳性药扩大了几倍”来证明自己的产品更好。
本篇我们以Zymeworks近期发表的一些数据来聊一聊安全性这个事情。
01 第一个问题,安全窗到底是什么?我们先把这个概念明确
MTD即maximum tolerated dose,指最大耐受剂量;MED, minimum effective dose,最小有效剂量。介于这两者中间的即为安全窗口了,安全窗口越大,意味着留出的给药的空间就更大,有效性自然也就容易上去了。
另外一个常提到的为RP2D (recommended phase 2 dose 2 dose)剂量,即临床II期的推荐剂量,看概念也能看出来,RP2D一般介于MTD和MED中间,出于有效性考虑,往往更接近于MTD。

既然概念是清晰的,是不是就有一个疑惑,为什么看到的数据从来都是和阳性药去比扩大了几倍,而没看到过安全窗口到底是几(比如8.5或者20)的这种数值呢?
02 DS8201临床爬坡是怎么设计的?
在此仔细翻了DS8201的数据,我们用这个经典产品来说说安全窗口是几这个问题,先看看它临床爬坡是怎么设计以及怎么爬的。
在食蟹猴上,8201 HNSTD为30mg/kg,换算到人则为9.7 mg/kg,取了这个剂量的1/12即0.8 mg/kg作为爬坡起始剂量。
然后看一下爬坡结果:

可以看到,1.6 mg/kg时,有1例病人出现了PR,但是3.2 mg/kg的3例病人都未出现PR,接下来便是PR2D的5.4 mg/kg了,而MTD为8 mg/kg。
那么这个时候MED能不能按1.6 mg/kg算就不好说了,如果可以,安全窗口是5,如果不能,则只能按照5.4mg/kg算,此时安全窗口是1.5。
鉴于3.2 mg/kg的3例病人的IHC染色都为0,做不出PR可能也正常,所以MED应该在1.6 -5.4mg/kg中间,这样看的话,DS8201安全窗口肯定大于1.5,最大为5。
但肯定不是所有药都做完I期再看安全窗,pre-clinical阶段数据怎么来看呢?有用鼠的有效剂量和鼠的耐受剂量算的;但更多的相对更准确的,是用鼠的有效剂量和猴的HNSTD(highest non-servicely toxic dose,最高非毒性剂量)的比值来算,所以经常看到,临床前数据的表述为“小鼠CDX或者PDX模型上药效和8201的相当,但是猴子更耐受,所以安全窗比它大了几倍 ”。
有道理吗?只要数据真实,其实是可以的。那这个数据真实怎么判定呢?思考一下里面的逻辑,比如抗体亲和力如何、表位有没有关系、linker稳定性、payload毒性,去比一比,如果有道理则能理解,如果完全说不通,那么这个HNSTD的数值准不准则需要考量。
03 HNSTD或者MTD 决定给药上限那么这个是靶点导致的还是毒素掉落导致的呢?
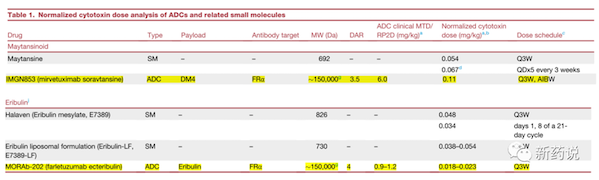
然后,就是一个比较有意思的现象,即free drug的MTD值,和ADC normalized payload的MTD/RP2D值水平整体相当。

简单来说就是,如果用的MMAE的payload, 临床给药周期都归一化到Q3W,normalized payload的量最后都集中在一个范围里,大致范围在0.05mg/kg上下。
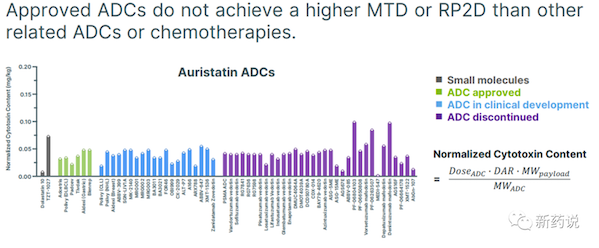

这个角度看,安全性肯定是和血浆中掉落的payload的量或者payload的代谢是有关系的,否则,不会出现不同靶点之间按照毒素类别来分RP2D or MTD的剂量。
那么如果payload定了,linker不是奇奇怪怪的比如IMMU132这种的,安全性跟靶点关系如何呢?
这里还是找两个linker-payload、 DAR值和偶联技术完全一样但是靶点不同的两个产品来看,比如第一三共的DS1062 (Trop2 ADC, GGFG-DXD, DAR4)和DS7300 (B7H3 ADC, GGFG-DXD, DAR4)。
表达上看,B7H3是比Trop2干净的;
临床前食蟹猴的HNSTDTrop2靶点的DS1062为10mg/kg, B7H3靶点的DS7300 为30mg/kg;
临床爬坡B7H3也爬的比trop2好很多, B7H3的RP2D在8-12mg/kg之间,高于Trop2 的RP2D为6mg/kg,Normalize到payload以后,和Her2 DXD相当。
所以,linker-payload端确定以后,安全性和靶点以及抗体的亲和力肯定是有关系。以上都说的是安全性,即能接受剂量的上限问题,MED是另外一个话题了。
04 2023年AACR会议,Zymeworks最近公布数据
其发表了一个摘要编号为1538的poster,在上述paper基础上,又讨论了linker稳定性与临床效果的关系,指出临床前Linker稳定性的数据并不能很好地反映临床效果,拿Enhertu为例,人体的Payload AUC/总抗AUC数值除以猴子的Payload AUC/总抗AUC数值,等于21.6;这个值在MMAE上面更高,几个MMAE的产品,人体的Payload AUC/总抗AUC数值除以猴子的Payload AUC/总抗AUC数值,从95倍-260倍不等。
这个里面的科学问题扎进去细究应该是有很多门道,但是要不要很纠结在这个点上,怎么说呢,我自己觉得,只要你不是FIC的产品,就跟安全窗口这件事情一样,和前面的产品去对比,还是有说服力的;如果是FIC的产品,可能小鼠MED和猴HNSTD的值会反映的更直接一些。只是HNSTD因为猴子的问题,剂量跨度往往比较大,不能做到很准确的数值,所以两个结合起来分析更明确一些。
做一个类比,比如抗体开发的时候,很怕遇到的风险之一为抗体的非特异结合,即off target时,而这种off target其实很多时候能通过鼠的PK去反应出来,如果药效和PK没有异常,那大概率off target 是没有问题的,很多抗体开发的时候都是因为药效异常然后发现是PK异常引起的,这个好理解,然后再往回去深究,发现是因为非特异的结合了其他靶点。所以总的就是,看数据不用只纠结一个点,动态平衡的去看。
小结
一直说安全窗口这个事情,有时候并没有那么仔细的审视过,本篇以DS8201为例说明了安全窗口如何计算,以及临床前如何去表述所开发产品的安全窗口。另外,关于毒性是源自毒素还是靶点,根据数据去做了一些梳理,感觉先跟毒素有关,毒素确定,跟靶点相关。至于偶联方式,比如定点偶联这种的能改善多少,感觉目前数据还是不够多,可能再攒攒临床数据总结起来能更明朗一些吧。
另外,ADC大家的目光越来越聚集在安全性上了,但是分析数据的时候也不能被带偏,只看MTD不考虑MED,或者只看MED的数据(比如拿一个MMAE去和DXD比药效)不考虑MTD都是不合适的。
参考文献1. Safety, pharmacokinetics, and antitumour activity of trastuzumab deruxtecan (DS-8201), a HER2-targeting antibody–drug conjugate, in patients with advanced breast and gastric or gastro-oesophageal tumours: a phase 1 dose-escalation study, The Lancet Oncology, 2017.2. The therapeutic window of antibody drug conjugates: A dogma in need of revision, Cancer Cell, 2022.3. Revisiting the dogma of antibody drug conjugates (ADCs): Emerging data challenge the benefit of linker stability and the primacy of payload delivery, Abstract #1538 , 2023 AACR
责编: editor
相关News
- 口服减重新星!恒瑞GLP-1R/GIPR激动剂Ⅱ期研究成功 2026-02-13
- 第一三共注射用德曲妥珠单抗新适应症在中国获突破性治疗认定,用于乳腺癌辅助治疗 2026-02-13
- 替尔泊肽单药治疗适应症获批 推动2型糖尿病管理范式升级 2026-02-13
- 口服胰岛素上市折戟 华润医药拟出售天麦生物 2026-02-13
- 翰宇药业醋酸格拉替雷注射液获得美国FDA批准 2026-02-13





