RNA靶向药物的生产工艺优化策略
2024-10-03
来源: drugdu
 1,286
1,286
RNA靶向药物是与小分子药物、抗体药物完全不同的全新药物类别,一方面可以针对细胞内的mRNA、ncRNA等,通过基因沉默抑制靶蛋白的表达从而实现治疗疾病的目的;另外一方面,也可基于mRNA开发新一代疫苗以及蛋白替代疗法,RNA靶向药物无疑是生物制药创新的战略性前沿领域,其未来潜在应用场景广阔,而mRNA产业化的生产工艺技术对mRNA的广泛应用以及产业化尤为重要。基于此,本文将着重梳理RNA靶向药物的生产工艺优化策略。稳定性化学修饰提升药物安全性与效力对于RNA靶向药物而言,化学修饰(除了组织靶向配体)主要有两个基本功能:首先,化学修饰可通过减弱细胞内源性免疫传感器对dsRNA的免疫反应,大幅提高药物的安全性;其次,通过增强RNA药物抵抗内源性内切酶和外切酶降解的能力,大幅提升药物疗效;针对siRNA药物,化学修饰还可以增强其反义链对RISC负载的选择性,提高序列选择性以降低脱靶RNAi活性,改变物理和化学性质以增强递送能力。通过特定的化学修饰可提高药物安全性、代谢稳定性、靶向性、结合亲和力和沉默效果,大幅拓展了药物的治疗窗口,因此化学修饰的绝对必要性在RNA靶向药物的临床开发早期挫折中已经得到了充分证明。迄今为止,FDA批准的所有RNA靶向药物都是化学工程的RNA类似物,支持了化学修饰的效用。针对特定化学修饰类别的单链寡核苷酸只是在序列上有所不同,但都具有相似的物理化学特性,因此具有共同的药代动力学和生物学特性。然而,每个化学类别都是不同的,即使2’-甲氧基乙基(2’-MOE)与2’-甲氧基(2’-OMe)之间的细微修改,也可能导致药效、药代动力学的重大变化。因此,精确定义RNA靶向药物的化学性质是非常必要的。下图显示了正在开发的主要化学修饰策略,包括核酸骨架替代、2’端核糖修改和5’碱基修饰以及其他可选的策略,目前上述方法已经在广泛使用以提高寡核苷酸药物的药物类属性,从而提高寡核苷酸药物动力学、药效学和生物学分布。就化学修饰的功能来看,广泛使用的修改包括2ʹ端核糖修改(如使用2’-MOE、2’-OMe、2’-F等替代2’端羟基)可以减少免疫原性,增加碱基配对溶解温度(Tm)和提高对核酸酶的抵抗;修饰糖基可以大大增加(锁定核酸LNA)或降低(解锁核酸UNA)与RNA的结合亲和力;核酸骨架的变化可以增加非特异性蛋白结合,消除主干电荷、增加疏水性(吗啉代-PMO或肽核酸-PNA),以抵抗核酸酶降解。

RNA靶向药物的化学修饰策略数据来源:PubMed具体化学修饰类型及其功效如下:●2’端核糖替代策略寡核苷酸在核糖2’端的羟基(-OH)可以被MOE、OMe、F等取代基替代,用于降低免疫原性、增加对核酸酶抗性、改善血浆的稳定性,从而延长了药物作用。(1)2’-甲氧基乙基(2’-MOE):可以提高药物PK,清除半衰期延长至2-4周,提高与靶向mRNA的结合能力以及效力,降低细胞毒性;(2)2’-甲氧基(2’-OMe):可以提高药物PK和稳定性,适度的提高效力与降低免疫原性;(3)2’-氟(2’-F):可提高药物与靶向mRNA的结合能力但不能提高稳定性与PK,更适用于RISC机制的siRNA药物,其修饰的核苷酸代谢物存在整合宿主细胞DNA或RNA的可能性,可导致部分核蛋白降解。在实际应用中,核糖2’端的修饰与RNase H活性不兼容,这意味着它们通常用于空间位阻型的ASO或用于Gapmer ASO的侧翼序列(如Mipomersen、Inotersen在侧翼序列中引入了2’-MOE修饰)。此外,2’-MOE修饰通常不被纳入siRNA设计中,Ago2的结构要求限制了可以使用的化学修饰类型,2’-MOE被证明对RNase H活性的ASO非常有用,但不支持与Ago2结合的siRNA。●5’端核酸碱基修饰策略5’-Methylcytidine(甲基胞苷)与5’-Methyluridine(甲基尿苷)修饰可以提高药物与靶mRNA的结合能力,降低免疫原性,但仅用于杂环修饰。嘧啶甲基化可提高每一修饰的寡核苷酸熔解温度约0.5℃,提高药物与靶mRNA的结合能力和稳定性,通常被应用于ASO药物中(如Ionis制药公司正在开发的ASO药物均有所使用)。核糖骨架修饰策略:寡核苷酸的磷酸二酯键可被硫代磷酸(PS)键所替代,即核苷酸间磷酸基的一个非桥接氧原子被硫取代,已经被广泛应用于RNA靶向药物的开发。PS核糖骨架是一种非常有效的修饰,具有核酸酶抗性和促进与血浆蛋白质结合的双重作用,从而减少肾脏清除率,增加药物的体内循环时间、改善药物的药代动力学,药物的清除半衰期提升至1-3天。PS核糖骨架支持多种作用机制的RNA靶向药物,尤其在Gapmer ASO和GalNAc siRNAs应用中效率较高。PS核糖骨架修饰在ASO设计中易于耐受,且不破坏RNase H活性,大部分已经上市的ASO药物中均有使用,在系统性给药后可被大多数细胞吸收,不需要靶向配体。相比之下,在每个连锁位点上都含有PS修饰的siRNA活性低于等效磷酸二酯(PO)siRNA,因此如果含有PS修饰的siRNA通常只在末端被修饰(如已获批上市的Patisran)。在RNA靶向药物中增加使用PS修饰的一个缺点是,每个PS修饰都会引入一个具有两种可能手性取向的立体中心,因此具有n个PS修饰的寡核苷酸是2n个外消旋体的混合物。这两种取向具有明显不同的药代动力学和药效学性质,虽然Sp取向的PS键对核酸酶裂解有更好的抵抗能力,但与Rp取向相比,它们也倾向于减少对碱基的侧边碱基的溶解温度,降低稳定性。由于分子的异质性往往对其临床开发有害,未来的RNA靶向药物可能会从最近开发的PS修饰寡核苷酸立体选择性合成技术中受益,如Wave Life Sciences已经开发了一种可扩展的方法来合成在每个PS链上具有固定立体化学的寡核苷酸,并正在开发具有固定立体化学的寡核苷酸药物用于各种适应症。PS修饰另一个缺点是它们降低了寡核苷酸对其靶标的结合亲和力,这一限制可以通过合并其他类型的修饰来弥补。值得注意的是,PS修饰提升药物对细胞核酸酶的耐药性,这会导致药物组织滞留和持久的药物作用,为应对例如由于长时间基因沉默而产生的毒性等不良反应,一个或多个PO键的结合可以通过降低其核酸酶的稳定性来调节寡核苷酸的耐久性。●2’端核糖修饰以及核苷酸桥连策略核苷酸桥接(BNAs)是通过在核苷酸的第2和第4个碳原子之间的桥连而被限制在固定构象中,最常用桥连策略是LNA、cEt、ENA。BNAs增强了药物对核酸酶的抗性以及对靶mRNA的亲和力(在LNA中,每个修饰过的核苷酸的熔解温度增加3~8℃)。虽然BNA修饰的核苷酸与RNase h并不相容,然而BNA修饰可被纳入Gapmer ASO的侧翼区域或也可被用于空间位阻的ASO中以改善靶标结合。值得注意的是,LNA修饰的RNA靶向药物在部分临床中观察到了肝毒性与肾毒性,增加了序列相关的风险,后续需继续关注。其他修饰策略:吗啉代寡核苷酸(PMO)是一类功能强大的合成寡核苷酸类似物,在核酸药物发展史上属于第3代反义寡核苷酸,PMO的电中性吗啉结构使其具有结合亲和性高和抗酶解稳定性强的特点。到目前为止,已经有两种PMO修饰的药物(Eteplirsen和Golodirsen)已经被FDA批准上市。PMO具有高稳定性和安全性的特点,由于在生理pH值下是中性的,不支持RNase H1活性,因此它们主要用于空间位阻机制的药物。PMO修饰的一个缺点是其缺乏与白蛋白结合能力导致较低的PK特性,这意味着可以通过肾脏排泄迅速清除导致疗效较低,因此需加大药物剂量。值得注意的是,PMO主链包含手性中心,这意味着PMO药物必然是外消旋的混合物。与上述PS修饰不同的是,迄今为止还没有研究过定义PMO立体化学的影响。RNA靶向药物的化学修饰类型与功效数据来源:PubMed递送系统有效提升靶向性和生物利用度不管化学修饰如何,RNA靶向药物的大小、亲水性和电荷对体循环、组织外渗、细胞摄取和内体逃逸都对药物开发构成了另外的挑战,因为核酸药物需要进入细胞内并完成内体逃脱才能发挥药理作用。
为了克服核酸药物的细胞摄取与内体逃脱效率低等障碍,递送系统对于提升药物靶向性和生物利用度是必要的。目前,针对RNA靶向药物开发的递送系统主要包括脂质纳米颗粒(LNPs)、聚合物、核酸纳米结构、外泌体等,RNA靶向药物也可以共价结合到特定的配体上,范围从相对较小的分子(如适配体、GalNAc等)到大分子(如多肽、抗体等Bioconjugation),配体定向输送有望改善针对特定类型细胞的靶向性。此外,递送系统是目前限制全球RNA靶向药物发展的主要瓶颈,脂质纳米颗粒(LNPs)与N-乙酰基半乳糖胺(GalNAc)已经在获批上市的核酸药物中得到了验证,其他多种递送系统的开发也在临床中正在进行验证。脂质纳米颗粒(LNPs)最初是作为siRNA药物在体内的递送系统而开发的,LNPs是一种复杂的结构(~100 nm),也被用于在体内传递mRNA等大RNA分子。LNPs可以包裹大量的RNA,保护RNA免受RNase降解和肾脏清除。临床上已经证明,添加聚乙二醇(PEG)脂类可以增强其在体内的循环时间,因为它在LNP表面周围形成空间屏障,且保护LNPs不与血浆蛋白相互作用,后者将以LNPs为靶点使其被MPS降解,因此PEG脂类在LNPs中使用已经成为了标准。然而,PEG脂类的使用是一把双刃剑,因为同样的空间屏障也抑制了LNPs与细胞膜的相互作用以及随后从内体逃逸的效率,因此微调PEG-脂质的数量和PEG链的长度是关键。LNPs在临床应用的缺点是其传递主要局限于肝脏和网状内皮系统,因为该组织的窦状毛细血管上皮提供了足够大的空间,允许这些相对较大的纳米颗粒进入,此外LNPs的局部递送已被成功地用于将siRNA递送到中枢神经系统。LNPs可以被多肽、PEG或其他赋予细胞特异性靶向的配体进一步功能化。然而,值得注意的是,LNPs复杂性的增加会使其制造复杂化并可能增加其毒性,这是一个可能限制其临床应用的主要问题。例如,LNPs包裹的siRNA药物(如Patisiran)在静脉注射以前需要用类固醇和抗组胺药进行预处理,以消除不必要的过敏反应。此外,生物可降解的离子化脂类可能在未来2~5年内进入临床前开发阶段,有望大幅提升药物的耐受剂量。
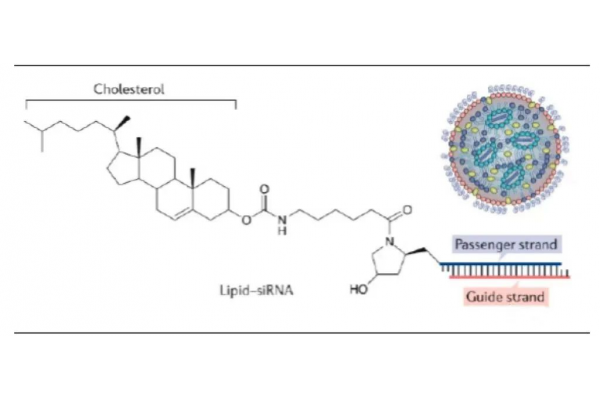
LNPs递送系统在siRNA药物的应用数据来源:Nature除了LNPs等递送系统以外,RNA靶向药物也可以共价结合到特定的配体上,范围从相对较小的分子(如适配体、GalNAc等)到大分子(如多肽、抗体等Bioconjugation),配体定向输送有望改善针对特定类型细胞的靶向性。其中,GalNAc是核酸药物靶向肝细胞应用最为广泛的配体,目前在临床试验中大约有三分之一的RNA靶向药物是与多价GalNAc配体结合的,靶向肝细胞表面的脱唾液酸糖蛋白受体(ASGPRs),大幅提升了核酸药物的靶向性和生物利用度。肝实质细胞表面高水平表达三聚体ASGPRs(每个细胞约105~106个),在中性pH下ASGPRs可以特异性与GalNAc结合,并在酸性环境(pH值5~6)时释放GalNAc,随后释放出来的ASGPRs可以被回收到细胞表面进行重用。因此,肝脏的适宜生理条件、ASGPRs的独特特性、GalNAc配体的无毒性质和偶联的简便性使其成为一种接近理想的全身核酸药物递送到肝细胞的方法。此外,GalNAc结合的寡核苷酸可以通过SC(表皮和真皮以下的脂肪组织)注射实现高效给药。皮下注射的药物释放到体循环的速度较慢,也可以进入淋巴系统,这给细胞受体更多的时间来调节吸收,同时皮下注射也更加快捷和容易,减少了治疗负担。更重要的是,目前临床上GalNAc结合的寡核苷酸药物相关的皮下给药相关局部不良事件发生率较低,而且额外安全性和耐受性将明显支持更少的每周一次给药,这是与LNPs递送系统的比较优势。siRNA药物的末端可以潜在地连接共轭物,然而尽量避免与引导链的5’端结合,因为该端磷酸与RNAi活性所需的Ago2中部区域侧链残基特异性接触,偶联到客链通常是为了不妨碍引导链的靶向沉默活性,相应的也能降低客链的脱靶基因沉默潜能。偶联Linker可以被设计成在细胞进入后可自动分解的,也可以通过使用内体中被切割的不耐酸连接剂、细胞质中被还原的二硫键连接剂或Dicer底物型siRNA的设计来实现。其他多种递送系统也在临床中开发中:(1)适配体治疗性寡核苷酸与核酸适配体的偶合也被用于增强siRNA和ASO靶向递送。适配体可以被认为是化学抗体,与各自的目标蛋白具有高亲和力,但与抗体相比有许多优势比如生产简单、成本低(即通过化学合成)、体积小、免疫原性较低。(2)多肽多肽是一种很有吸引力的配体来源,可以赋予治疗性寡核苷酸缀合物以组织/细胞靶向和细胞穿透或内吞能力。CPP(也称为蛋白质转导域)通常很短(通常约30个氨基酸),其最有前途的应用之一是其直接化学偶联于带电中性如PMO或PNA修饰的ASO药物。(3)内源性外泌体外泌体是由脂质双层囊泡组成的,被认为是通过转运复杂的大分子(即核酸、蛋白质和脂质)在细胞间传递信息的内源性递送系统,不会激活先天或后天免疫系统。外泌体在寡核苷酸药物递送方面拥有多重优势,如安全性较高、能够穿过生物膜(包含血脑屏障)、可以通过抑制MPS清除和改善细胞摄取来增加体循环半衰期。外泌体用于核酸药物递送的主要挑战是有效装载,可通过电孔等方式进行,其他途径也在开发中。(4)DNA纳米结构DNA纳米结构可用于寡核苷酸的递送,主要包括DNA折纸、多边形DNA纳米结构等。用于核酸输送应用的DNA纳米结构通常是模块化的,在结构本身的设计中包含核酸药物,目前临床上已经设计出相应的ASO和siRNA药物。DNA纳米结构不会在肝脏中堆积,而且可以被设计成小的纳米结构(约20nm),这意味着肝外传递是可能的。目前,国内景泽生物正在开发基于DNA四面体框架核酸载体平台,用于寡核苷酸、小分子等药物的递送。除了递送系统,给药的方法和部位对RNA靶向药物的生物利用度和生物分布都有深远的影响。临床开发中的RNA靶向药物已经通过局部吸入(肺部)、局部注射(如眼睛、心脏或脑脊液)应用于GalNAc结合和LNP配方的ASO和siRNA药物,这一途径避免了肝脏的首通道代谢。目前临床开发的候选药物大多针对的肝脏,然而RNA靶向疗法正在开发使用局部给药规避全身药物分配的限制,将RNA靶向药物保留在局部区域内以延长释放时间,这项工作目前是一个活跃的学术研究领域。BERAs代表着RNA靶向药物的生产工艺优化方向纯均质制剂对于RNA靶向药物在人体内的生物学活性和治疗窗口是必不可少的。目前,RNA靶向药物主要是通过化学合成或依赖重组T7 RNA聚合酶在体外转录生产,然而这些生产出来的RNA制剂的局限性是在天然寡核苷酸中添加了过多的人工修饰或者缺乏必要的转录后修饰,这可能导致不同的折叠特性、生物活性和安全性。此外,上述生产方式所获取更高数量级的siRNA或ASO材料的成本仍是昂贵的,合成寡核苷酸的长度或大小也受到限制,因此开发更经济、更有效、可大规模化的生产方式是必要的。大规模生物发酵生产技术(BERAs)有望提供大量具有适当折叠和自然修饰的生物RNA制剂,这些制剂对RNA的高阶结构、稳定性、活性和安全性至关重要。原则上,将目标RNA编码序列引入质粒,并将设计的质粒转染到在适当条件下生长的宿主细胞中进而转录生成。然而,异质性RNA对细胞内核酸切酶非常敏感,生出的RNA制剂可能不会积累到理想的水平,使用稳定性的RNA支架(如rRNA、tRNA)、siRNA-binding的p19结合蛋白或在RNase III缺陷细菌中直接过表达,在这种条件下目标RNA制剂则无法被细胞内核酸切酶降解,是提高生产效率的有效途径。
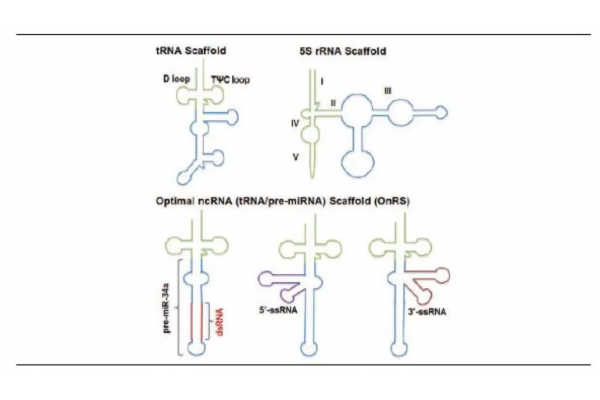
BEARs生产所使用的RNA稳定性支架数据来源:Nature生产工艺中另一重要的考量因素是递送系统及辅料的复杂性、均匀性、稳定性和细胞毒性,如纳米颗粒、聚合物、多肽等。脂质和聚合物纳米粒子已经广泛用于改善RNA靶向药物的药代动力学性质,但其生产工艺较为复杂以及成品中往往有一定程度的异质性粒子组成,使其更加难以建立有效的治疗窗口。此外,纳米颗粒在储存期间或给药后会变得不稳定,并释放出分解产物,从而导致难以追踪的细胞毒性,以上问题需要在后续生产工艺优化过程中进行最大程度上的解决。
责编: editor相关News
- 苑东生物EP-0210单抗注射液I期临床试验完成首例受试者给药 2026-02-10
- 智飞生物:重组带状疱疹ZFA01佐剂疫苗(CHO细胞)临床试验获批 2026-02-10
- 和誉医药FGFR4抑制剂依帕戈替尼获FDA快速通道资格,用于经ICI和mTKI治疗且FGF19过表达的晚期HCC患者 2026-02-10
- 赛诺菲「Rilzabrutinib」获美国突破疗法 + 日本孤儿药,中国已申请上市 2026-02-10
- 国产重磅 ADC 新适应症获批上市 2026-02-10
您已成功订阅,无需重复提交。
确认
邮件订阅
请输入正确邮箱!
订阅
邮件订阅热门医贸资讯,了解第一手信息。
行业动态更多
-
苑东生物EP-0210单抗注射液I期临床试验完成首例受试者给药
2026-02-10 -
智飞生物:重组带状疱疹ZFA01佐剂疫苗(CHO细胞)临床试验获批
2026-02-10 -
赛诺菲「Rilzabrutinib」获美国突破疗法 + 日本孤儿药,中国已申请上市
2026-02-10





