AOC能否成为寡核苷酸治疗的“下一站”?
2025-12-17
来源: drugdu
 202
202
过去几年,核酸产业迅速发展,多款小核酸药物成功获批上市,为罕见病、传染病等领域的治疗带来了革命性突破,推动基因治疗进入了高速发展的黄金时期。然而,传统小核酸药物在递送过程中仍面临诸多瓶颈,如以GalNAc递送技术为代表的疗法多局限于肝脏靶向,难以实现肌肉、中枢神经等肝外组织的有效递送,且存在半衰期较短、脱靶毒性较高等问题,极大限制了其临床应用范围。
而早几年,AOC(抗体-寡核苷酸偶联物)的出现,使得过去制约小核酸药物发展的递送难题得到初步解决,其独特的结构设计与技术优势也使其成为寡核苷酸治疗领域的“下一站”核心方向。
而如今,在经历了对AOC结构的深度认识,MNC强势资本推动,靶向递送与偶联技术的迭代升级后,AOC的现在与未来又会怎样的场景?
各司其职
AOC药物的三大结构
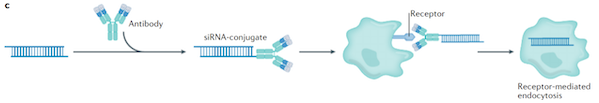
所谓AOC,即将抗体与寡核苷酸通过连接子偶联后形成的复合物,其兼具了抗体的靶向性与寡核苷酸的治疗活性,结构形式上与ADC类似,只是有效载荷从小分子毒素替换成了具有基因调控功能的核酸药物。
 图片来源:Kalina Paunovska, et al. Drug delivery systems for RNA therapeutics
图片来源:Kalina Paunovska, et al. Drug delivery systems for RNA therapeutics
相较于以GalNAc递送为代表的传统寡核苷酸药物,AOC具备三大核心优势:
一是肝外递送能力,通过选择不同的靶向抗体,可实现对肌肉、中枢神经、肿瘤等肝外组织的精准递送,例如针对TfR1靶点的AOC可穿透血脑屏障,为阿尔茨海默病、脊髓性肌萎缩症等中枢神经系统疾病提供新的治疗方案。
二是更长的半衰期,抗体分子在血液中具有较强的稳定性,偶联后的AOC半衰期可达数天至数周,远长于传统寡核苷酸药物(通常为数小时至数天),大幅降低了给药频率。
三是更低的脱靶毒性,由于AOC仅针对表达特定抗原的靶细胞发挥作用,对正常细胞的影响极小,有效减少了传统寡核苷酸药物可能引发的免疫反应、肝肾功能损伤等脱靶效应。
而机制机构上,AOC的三大结构分工明确:抗体负责识别并介导靶细胞的特异性内化,确保药物精准定位至目标组织;连接子维持体内稳定并在细胞内触发载荷进行释放,平衡药物循环稳定性与胞内起效效率;而寡核苷酸则通过与靶mRNA特异性互补结合,实现“基因沉默”或“剪接调控”,从根源上干预疾病进程。
AOC作为继ADC之后的新一代精准治疗平台,正以其在基因表达水平调控的独特优势快速发展。目前已有多款候选药物进入关键临床阶段,主要用于治疗遗传性和肌肉相关疾病。随着技术的持续迭代与临床数据的不断积累,AOC的未来发展方向将更加多元,有望在更多治疗领域实现突破。
多联设计:实现功能协同与疗效升级
随着“双特异性抗体”技术的逐渐成熟,领域内已迎来成药性验证的里程碑事件,如百利天恒自主研发的EGFR×HER3双抗ADC药物iza-bren已在中国提交鼻咽癌适应症的上市申请。与之对应,未来AOC也将不再局限于单一的基因沉默功能,而是有望整合多种功能模块:
•
一方面,可使用双特异性抗体作为载体,同时靶向两个不同的抗原或表位,例如一端靶向肿瘤细胞,另一端靶向免疫细胞,构建更复杂的AOC,实现更强的免疫招募效果。
•
•
另一方面,可借鉴双载荷ADC的设计思路,在AOC基础上同时搭载免疫激活寡核苷酸和基因调控寡核苷酸,实现“治疗+免疫调节”双重作用,进一步提升治疗效果,尤其适用于肿瘤等复杂疾病。
•
肿瘤/免疫领域拓展:打开更广阔市场空间
一般而言,AOC疗法的疾病目标通常与其靶点息息相关:Avidity的AOC-1001、AOC-1004等产品,因为抗体靶点为TfR1,其适应症也因此多为肌肉、神经等组织相关疾病,如DMD、肌强直性营养不良等;而Tallac的TAC-001、ALX的ALTA-002,靶点选择了CD22与SIRPa,适应症则聚焦于实体瘤。
显然,靶点选择是制约AOC适应症范围的核心因素,那么继肌肉、中枢神经与肿瘤适应症之后,自免疾病或许也会因其庞大的市场需求成为AOC疗法的下一个重要目标。
目前,市场已有部分企业开始布局免疫激活型AOC,通过偶联TLR激动剂、STING激动剂等免疫激活分子,在实现靶向基因沉默的同时,激活机体免疫系统,尤其适用于肿瘤治疗。此外,AOC还可与免疫检查点抑制剂联合使用,通过沉默免疫抑制相关基因,增强免疫检查点抑制剂的治疗效果,为肿瘤联合治疗提供新的组合方案。
https://news.yaozh.com/archive/46635.html
责编: editor相关News
- 为何AI抗病毒新药研发冷门却是刚需? 2026-02-01
- 原研神话打破!国产黄褐斑新药孚立美®京东首发 2026-02-01
- 巴基斯坦对华头孢羟氨苄作出反倾销终裁 2026-02-01
- 三星生物“狂飙” 2026-02-01
- 全球首个获批临床:“自体再生胰岛”治疗2型糖尿病!瑞普晨创开启双适应症自体再生新赛道 2026-01-31





