誉衡生物宣布莫替福肽(APHEXDA®,motixafortide)获中国澳门药物监督管理局批准上市
2024-09-23
来源: drugdu
 373
373
 莫替福肽澳门正式获批
莫替福肽澳门正式获批
2024年9月20日,广州誉衡生物科技有限公司(简称“誉衡生物”)宣布靶向趋化因子受体4(CXC chemo-kine receptor 4,CXCR4)的全球首个多肽类药物莫替福肽(APHEXDA®,motixafortide)近日获得中国澳门特别行政区药物监督管理局正式批准上市。据WHO ATC (Anatomical Therapeutic Chemical Classification System,解剖学治疗学及化学分类系统)药品分类管理系统获批为免疫增强剂L03AX23,在多发性骨髓瘤(MM,multiple myeloma)患者中联合粒细胞集落刺激因子(G-CSF)动员造血干细胞用于外周血的干细胞单采及随后的自体移植。继海南博鳌之后,澳门成为莫替福肽在誉衡生物亚洲授权区内第二个获得批准的地区。莫替福肽已于2023年9月在美国获得新药上市批准,是自2008年以来美国首个获批的多发性骨髓瘤干细胞动员创新药物,也是第一个成功上市的靶向CXCR4的多肽类药物。
 根据WHO的ATC编码规则,L03A亚群属于免疫增强剂;对于不属于现有任何治疗分类的新分子药物,第4级代码将被分配到X组。莫替福肽获颁代码L03AX23的第4级为X,代表其不属于现有的任何4级治疗分类,莫替福肽成为首个被WHO纳入ATC分类系统的CXCR4多肽类药物,属于首创新药。
根据WHO的ATC编码规则,L03A亚群属于免疫增强剂;对于不属于现有任何治疗分类的新分子药物,第4级代码将被分配到X组。莫替福肽获颁代码L03AX23的第4级为X,代表其不属于现有的任何4级治疗分类,莫替福肽成为首个被WHO纳入ATC分类系统的CXCR4多肽类药物,属于首创新药。
加速惠及中国患者
自2021年“港澳药械通”政策正式落地,打通了国际先进创新药械快速进入临床应用的通道,在港澳获批上市的药品可在大湾区内地指定医疗机构使用,为大湾区居民带来了治疗便利。截至2024年,通过“港澳药械通”政策累计批准19家指定医疗机构,覆盖在粤港澳大湾区内地9市:广州、深圳、珠海、佛山、惠州、东莞、中山、江门、肇庆。
誉衡生物将依托粤港澳大湾区“港澳药械通”及海南博鳌乐城先行区的特许药械等利好政策,加快这款多发性骨髓瘤治疗及干细胞移植领域的创新药物在中国大陆患者的可及性。基于获得上市批准的全球多中心临床三期GENESIS研究中预期无种族差异,今年5月誉衡生物获得国家药品监督管理局药品审评中心批准开展一项桥接三期临床研究。6月正式落地博鳌乐城先行区,将首先在博鳌超级医院应用于临床使用。并同时启动了新加坡地区的新药上市注册申请。
创新CXCR4多肽药物
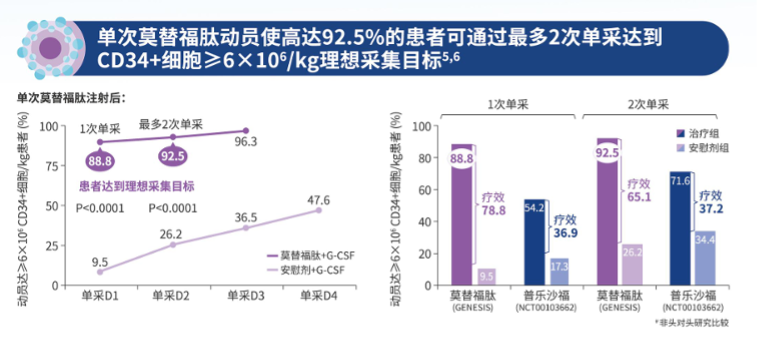
在骨髓微环境中,CXCR4与基质细胞衍生因子1(SDF-1/CXCL12)在造血干细胞归巢和驻留、调节免疫细胞分布的过程中起重要作用,造血干细胞通过CXCR4与SDF-1/CXCL12相互作用被锚定在骨髓基质内。莫替福肽是一款皮下注射的CXCR4拮抗剂,具有高亲合力的创新环肽结构,受体占有时间超过72小时,并有延长的体内活性。莫替福肽通过6个位点与干细胞表面CXCR4受体结合,精准阻断CXCR4与SDF-/CXCL12的相互作用,使得干细胞失锚定从骨髓中释放并迁移到外周血中,从而显著提高CD34+细胞采集量,缩短采集周期,减少采集次数,增加移植成功率。同时调节免疫细胞的迁移与活化,影响机体的免疫反应。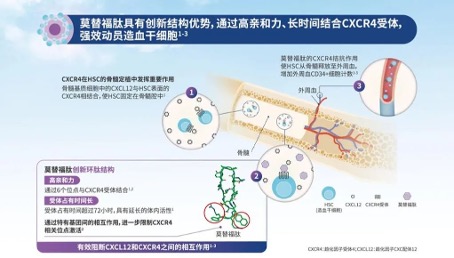 莫替福肽的批准是基于GENESIS全球多中心3期注册研究(NCT03246529)的结果,该研究旨在比较莫替沙福肽+G-CSF与安慰剂+G-CSF在自体干细胞移植(autologous hema⁃topoietic stem cell transplantation,ASCT)前接受造血干细胞动员的MM患者中的安全性和有效性。这项随机、双盲、安慰剂对照研究均达到了所有主要和关键次要终点,安全性良好且耐受。研究结果已于《自然-医学》(Nature Medicine)杂志发表。这项临床研究显示,在莫替福肽+ G-CSF可高效动员干细胞。仅一次用药,88.8%的患者通过一次单采、92.5%的患者最多通过两次单采即可获得理想剂量6×106/公斤体重CD34+细胞;接受安慰剂+G-CSF的患者中比例分别为9.5% (OR 118.0, 95% CI 25.36–549.35, P < 0.0001)和26.2% (OR 53.3, 95% CI 14.12–201.33, P < 0.0001)。莫替福肽显著提高了造血干细胞的采集效率和质量,为移植成功奠定基础。
莫替福肽的批准是基于GENESIS全球多中心3期注册研究(NCT03246529)的结果,该研究旨在比较莫替沙福肽+G-CSF与安慰剂+G-CSF在自体干细胞移植(autologous hema⁃topoietic stem cell transplantation,ASCT)前接受造血干细胞动员的MM患者中的安全性和有效性。这项随机、双盲、安慰剂对照研究均达到了所有主要和关键次要终点,安全性良好且耐受。研究结果已于《自然-医学》(Nature Medicine)杂志发表。这项临床研究显示,在莫替福肽+ G-CSF可高效动员干细胞。仅一次用药,88.8%的患者通过一次单采、92.5%的患者最多通过两次单采即可获得理想剂量6×106/公斤体重CD34+细胞;接受安慰剂+G-CSF的患者中比例分别为9.5% (OR 118.0, 95% CI 25.36–549.35, P < 0.0001)和26.2% (OR 53.3, 95% CI 14.12–201.33, P < 0.0001)。莫替福肽显著提高了造血干细胞的采集效率和质量,为移植成功奠定基础。
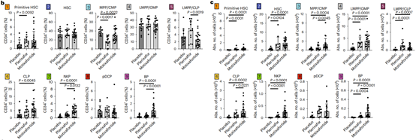
 同时,这项研究显示了莫替福肽+G-CSF显著增加了常见淋巴样祖细胞 (CLP)、自然杀伤细胞前体 (NKP) 和嗜碱性粒细胞前体 (BP) 的百分比。与小分子CXCR4阻断剂普乐沙福(plerixafor)+G-CSF相比,莫替福肽+G-CSF显著增加了多能祖细胞和常见髓系祖细胞 (MPP/CMP)、NKP 和 BP的百分比。对造血干细胞和祖细胞(HSPC)亚群绝对数量的定量分析显示,与安慰剂+G-CSF 相比,莫替福肽+G-CFS动员造血祖细胞的绝对数量高出10.5倍。与普乐沙福+G-CSF 相比,莫替沙福+G-CSF 显著增加了 MPP/CMP、CLP和BP的数量。这些数据表明,莫替福肽诱导了多种HSPC亚群的全动员,这些亚群能够进行广泛的多谱系造血重建。
同时,这项研究显示了莫替福肽+G-CSF显著增加了常见淋巴样祖细胞 (CLP)、自然杀伤细胞前体 (NKP) 和嗜碱性粒细胞前体 (BP) 的百分比。与小分子CXCR4阻断剂普乐沙福(plerixafor)+G-CSF相比,莫替福肽+G-CSF显著增加了多能祖细胞和常见髓系祖细胞 (MPP/CMP)、NKP 和 BP的百分比。对造血干细胞和祖细胞(HSPC)亚群绝对数量的定量分析显示,与安慰剂+G-CSF 相比,莫替福肽+G-CFS动员造血祖细胞的绝对数量高出10.5倍。与普乐沙福+G-CSF 相比,莫替沙福+G-CSF 显著增加了 MPP/CMP、CLP和BP的数量。这些数据表明,莫替福肽诱导了多种HSPC亚群的全动员,这些亚群能够进行广泛的多谱系造血重建。
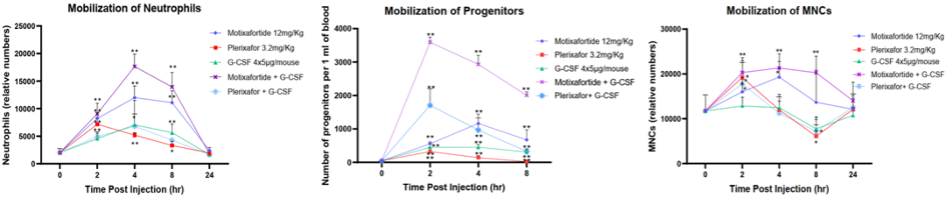
 另一项研究也显示莫替福肽无论是单独使用还与G-CSF联合使用,其疗效都明显优于普乐沙福,可快速动员细胞(中性粒细胞、单核细胞和造血祖细胞)进入外周血,并且在注射后24小时内仍保持较高的动员水平。
另一项研究也显示莫替福肽无论是单独使用还与G-CSF联合使用,其疗效都明显优于普乐沙福,可快速动员细胞(中性粒细胞、单核细胞和造血祖细胞)进入外周血,并且在注射后24小时内仍保持较高的动员水平。
CXCR4广泛的应用前景
基于莫替福肽的生物学机制以及广泛的临床前及临床探索,该药物还具有更广的应用潜力,例如在肿瘤免疫治疗和放化疗中展现出显著的增效减毒作用,也可以增强感染高风险和免疫力低下人群的免疫力。 肿瘤免疫治疗
肿瘤免疫治疗
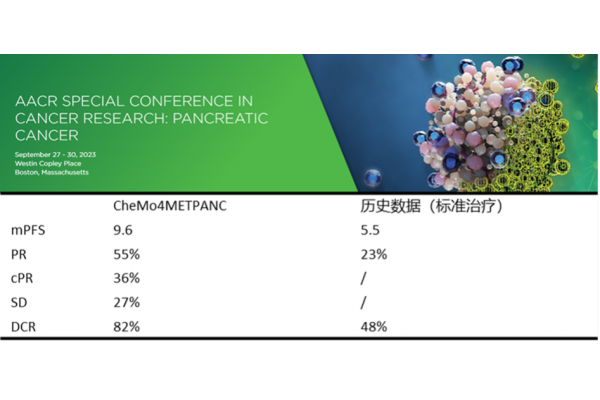
CXCR4在多种免疫细胞上有表达,参与调节免疫细胞的迁移、活化和功能。莫替福肽通过阻断CXCR4,可以影响免疫细胞在体内的分布和活化状态,减少免疫抑制细胞在肿瘤微环境中的聚集,同时增加效应T细胞等抗肿瘤免疫细胞的浸润,从而增强机体的抗肿瘤免疫反应。与免疫疗法及其他疗法联合使用时,莫替福肽显著提高了抗肿瘤反应的强度和持久性,使“冷”肿瘤(如胰腺癌)变“热”,提高治疗敏感性。一项莫替福肽与PD-1抑制剂及标准化疗联合用药治疗一线胰腺癌的二期临床研究(CheMo4METPANC,NCT04543071)在2023年AACR会议上发布。研究显示探索性阶段入组的11例患者,总体应答率(ORR)为64%;无进展生存期中位数(mPFS)为9.6个月,疾病控制率(DCR)为82%。
同时,CXCR4在75%的肿瘤细胞中高度表达,包括胰腺癌、乳腺癌、胃癌、前列腺癌、肾癌等,并与肿瘤的趋化、侵袭、血管生成和细胞增殖有关联。通过抑制CXCR4可以抑制肿瘤细胞的迁移、治疗过程中癌细胞的逃逸、以及抑制血管生成等,具有多种机制的抗肿瘤潜力。
放化疗辅助用药
在放化疗过程中,初步研究表明莫替福肽不仅增强了放化疗对肿瘤细胞的杀伤作用,还通过减轻治疗引起的中性粒细胞减少症等副作用,提高了患者的耐受性和生活质量。在非临床研究中发现莫替福肽对化疗引起的血细胞减少和血小板减少症的恢复也有积极影响,能够刺激巨核细胞和血小板的生成。单次给药后可观察到祖细胞和血小板的增加,重复给药后效果进一步增强。非临床也发现CXCR4抑制剂有可能逆转免疫检查点药物介导的心脏毒性。
免疫修复在感染高风险或免疫力低下的人群中,莫替福肽通过动员造血干细胞,不仅增加了外周血中免疫细胞的数量,并且促进了免疫细胞的再生与增殖,增加外周血T细胞、B细胞、NK细胞、中性粒细胞等重要的免疫细胞的数量,有助于增强机体对病原体和肿瘤细胞的防御能力。自免及纤维化疾病自身免疫性疾病通常伴随着免疫细胞的异常活化和不当迁移,CXCR4抑制剂通过阻断CXCR4与其配体SDF-1的相互作用,可以减少免疫细胞在炎症部位的聚集,减轻自身免疫反应。体外和动物模型中的初步研究显示,CXCR4抑制剂可能对银屑病、特应性皮炎、肺纤维化和类风湿关节炎等疾病有一定的效果。莫替福肽通过精准阻断CXCR4-SDF-1/CXCL12轴的相互作用,在造血干细胞动员、免疫细胞调节等方面展现出独特的生物学机制和广泛的临床应用潜力。随着研究的不断深入和临床应用的拓展,莫替福肽有望为更多患者和人群带来福音。基于莫替福肽的作用机制特点和已有的临床数据,誉衡生物计划在实体肿瘤及细胞治疗中开发其他潜在适应症,包括与自主研发的全人源PD-1单抗赛帕利单抗联合用药治疗一线胰腺癌。其它潜在适应症包括细胞治疗中的CD34+细胞动员、改善化疗药物的骨髓抑制、升白、免疫修复等。 多发性骨髓瘤治疗的临床需求 多发性骨髓瘤是第二常见的血液恶性肿瘤,亚洲人口规模庞大,2022年新发病例数为 51,400 例,我国发病率约为1.6/10万,发病率逐年增加。GLOBOCAN 报道我国每年新增患者约2万,死亡约1.5万。根据Cancer Statistics Review初步预计我国总患者超过10万人。造血干细胞移植是一种重建患者正常造血和免疫功能的治疗方法,是MM患者治疗非常重要的治疗方式。《2023年CSCO造血干细胞移植指南》首次将自体造血干细胞移植写入移植指南中,并对其在多发性骨髓瘤中的应用进行了详细推荐。根据NCCN多发性骨髓瘤治疗指南及中国指南,自体干细胞移植是多发性骨髓瘤的标准治疗方式的一部分,并为患有这种癌症的患者提供了长期生存机会。由于造血干细胞在外周血的含量极低,必须通过动员才能使造血干细胞自骨髓释放至外周血,以达到足够的白细胞量以及CD34+细胞计数,再通过血细胞分离采集技术而获得。指南建议最好一次收集两次移植所用干细胞,为二次移植或未来移植做好准备,且研究表明移植的干细胞数量与患者预后呈正相关。目前,单次ASCT推荐的自体外周血干细胞最低剂量为2×106/kg体重的CD34+细胞,理想剂量为≥5×106/kg体重CD34+细胞[1]。理想剂量CD34+细胞可以加快造血重建,并降低治疗相关并发症的发生,减少输血需求等。传统的初始动员方案是粒细胞集落刺激因子G-CSF单用或联合化疗,32%的淋巴瘤和14%MM患者无法动员采集到最低剂量的CD34+细胞[2]。初始动员失败的患者需再次动员,而传统动员方案再动员的失败率超过70%[3]。动员失败严重限制了ASCT对相关疾病的治疗。因此移植对干细胞动员剂有更高要求,具有良好动员活性的药物可以显著降低ASCT的风险和负担。
相关News
- 英矽智能携手海正药业,8个月完成临床前候选化合物提名 2026-01-04
- DLL3靶点再现重磅BD 泽璟制药在研药物“卖”出超12亿美元 2026-01-04
- 荣昌生物「维迪西妥单抗」新适应症拟纳入突破性疗法 2026-01-04
- 兴盟生物首获国际GMP认证,创新单抗药物克瑞毕®加速走向全球 2026-01-04
- 诺和诺德、礼来争霸战火“东渐” 2026-01-04





