Cell:程亦凡团队揭示细胞间TGF-β信号激活与传导机制
2024-09-20
来源: drugdu
 1,840
1,840
以下文章来源于生物世界 ,作者生物世界
转化生长因子β(TGF-β)是一种多功能细胞因子,在发育、免疫、癌症和纤维化等过程中发挥着关键作用。TGF-β有三种不同的基因表达产物(TGF-β1、TGF-β2和TGF-β3),它们均以非激活(潜伏)形式表达,即L-TGF-β,“激活”对于其功能至关重要。
大多数靶向TGF-β的治疗策略并未靶向特定的潜伏和/或激活机制,而是对TGF-β信号通路的整体抑制,并具有显著毒性。对潜伏和激活的更深入理解可能有助于开发更好的TGF-β靶向治疗策略。
传统观念认为,成熟的TGF-β必须从L-TGF-β1物理解离后才能发生信号转导。而程亦凡团队之前的研究显示,整合素αvβ8介导的TGF-β自分泌信号转导可以在TGF-β1从其潜伏形式释放之前发生。
2024年9月16日,加州大学旧金山分校程亦凡团队在国际顶尖学术期刊 Cell 上发表了题为:Dynamic allostery drives autocrine and paracrine TGF-β signaling 的研究论文,揭示了潜伏的转化生长因子β(L-TGF-β)在与整合素αvβ8结合时的全新活化机制。
该研究显示,与TGF-β1缺失的小鼠(在发育早期死于组织炎症)不同,通过基因工程技术构建的TGF-β1无法从L-TGF-β1中释放的小鼠没有早期致死性组织炎症并存活。结合冷冻电镜技术和细胞实验,该研究揭示了自分泌TGF-β1信号转导的动态构象调节机制,无需TGF-β1释放,αvβ8结合重新分配了L-TGF-β1的固有柔韧性,使其能够与受体结合。动态构象调节可以解释TGF-β3的潜伏/激活机制,并解释为什么TGF-β3的功能与TGF-β1不同,这表明其广泛适用于其他柔性细胞表面受体/配体系统。 成熟的TGF-β的潜伏是由于在生物合成过程中,其N端前体蛋白被furin酶切割后,与TGF-β非共价结合所导致的。前体蛋白环绕成熟的TGF-β二聚体形成环状的二硫键连接的同源二聚体(潜伏相关肽,LAP),形成L-TGF-β。
成熟的TGF-β的潜伏是由于在生物合成过程中,其N端前体蛋白被furin酶切割后,与TGF-β非共价结合所导致的。前体蛋白环绕成熟的TGF-β二聚体形成环状的二硫键连接的同源二聚体(潜伏相关肽,LAP),形成L-TGF-β。
潜伏相关肽(LAP)具有以下四个基本功能:1) 通过束缚结构域的环形结构将成熟的TGF-β与受体隔离,从而赋予其潜伏状态;2) 通过与TGF-β微环境分子(例如糖蛋白A重复优势蛋白,GARP)结合,将L-TGF-β密封在基质或细胞表面,从而稳定并通过共价键将L-TGF-β固定在细胞表面;3) 促进正确折叠和高效分泌;4)与激活蛋白质(特别是整合素)结合。
激活的成熟TGF-β是通过二硫键连接的同源二聚体,在TGF-β受体(TGF-βR)结合区域中高度保守,特别是成熟的TGF-β1和TGF-β3,它们与TGF-βR(TGF-βR1/TGF-βR2)结合的亲和力相似。尽管如此,缺乏TGF-β1或TGF-β3的小鼠表现出不同的表型,这可能是由于TGF-β1和TGF-β3的LAP之间整体同源性较低,导致其处于潜伏或激活状态的个体机制不同所致。
有趣的是,TGF-β1和TGF-β3的LAP都含有整合素结合基序RGDLXXL/I,可以与两种整合素αvβ6和αvβ8结合,这共同构成了体内的TGF-β1主要和TGF-β3部分功能作用机制。整合素结合最终导致TGF-β激活,并通过尚未阐明的机制产生自分泌或旁分泌的TGF-β信号通路。
整合素αvβ6和αvβ8之间的结构和序列差异表明,它们可能具有不同的TGF-β激活机制,这可能导致TGF-β在不同背景下具有特定的功能。对于αvβ6,全局构象变化将来自肌动蛋白-细胞骨架的力传递给L-TGF-β,破坏LAP并允许释放成熟的TGF-β进行旁分泌信号传递。这种机制需要高度保守的β6亚基胞质结构域,其与肌动蛋白细胞骨架结合。然而,从αvβ8介导的激活所释放的成熟TGF-β1很难检测到,这表明旁分泌TGF-β1信号传递效率低下。因此,αvβ8不发生全局构象变化,αvβ8介导的TGF-β1激活不需要肌动蛋白-细胞骨架产生的力,因为β8亚基的胞质结构域不需要激活,也不与肌动蛋白结合。
研究团队之前的工作揭示,αvβ8结合使L-TGF-β1的束缚性增强,这使他们提出假设——成熟的TGF-β1可以在不从潜伏复合物中释放的情况下被激活,并在细胞实验中验证了这一假设。因此,研究团队进一步推测,将L-TGF-β1与αvβ8结合产生的柔韧性足以使成熟的TGF-β1暴露给TGF-βR进行自分泌信号传递,而不需要将其释放出来。然而,在没有机械力的情况下,αvβ8结合如何在L-TGF-β通过与GARP结合而稳定后诱导其柔韧性,这一机制是否具有生理学相关性,目前尚不清楚。因为人们普遍认为,TGF-β的释放和旁分泌信号传递是其功能所必需的。
在这项研究中,研究团队首先验证了首先验证了不释放TGF-β1的自分泌信号具有生理学意义。研究团队设计了只表达tgfb1的基因敲入小鼠,该小鼠具有突变的furin裂解位点,不能释放TGF-β1。
在这些小鼠中,TGF-β信号仍然完整,因为它们能够存活、繁殖,并且免受TGF-β1缺乏引起的致命早期组织炎症的影响,这证明了成熟TGF-β与它的潜伏复合物结合后可以被激活、结合到其受体上并传递信号。
接下来,研究团队探索了TGF-β1与TGF-βR结合而不释放的机制,描述了一个动态变构模型——TGF-β1与αvβ8结合后,L-TGF-β RGD结合区域周围的局部构象熵降低,导致L-TGF-β/GARP远端区域的构象熵增加,从而使成熟的TGF-β暴露给TGF-βR而不释放。
为了支持这一模型,研究团队确定了L-TGF-β3/GARP的结构,显示L-TGF-β1和L-TGF-β3的基态构象熵不仅决定了非整合素依赖的TGF-β激活的基线水平,而且决定了可用于驱动整合素依赖的TGF-β激活的熵。与L-TGF-β1相比,L-TGF-β3中整合素介导的熵变化水平更高,导致成熟TGF-β3的旁分泌释放,而不是TGF-β1,这表明自分泌和旁分泌TGF-β信号传递存在亚型特异性机制。此外,可以通过稳定αvβ8/L-TGF-β/GARP的不同柔性区域来改变熵重新分配的方向。
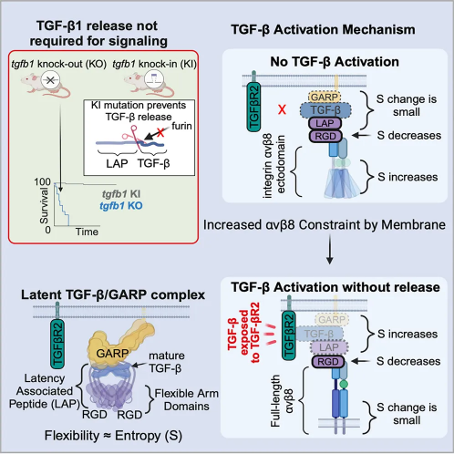 总的来说,这些结构和细胞研究揭示了一种基于蛋白质动态的远端跨蛋白质复合物重新分配构象熵的变构机制,该机制不受肌动蛋白-细胞骨架力的影响,并决定自分泌和旁分泌TGF-β功能。这些结果进一步推进了TGF-β家族成员的潜伏和激活的机制理解,为通过柔性细胞表面蛋白的蛋白质动态来理解信号传递的结构理解提供了路线图。
总的来说,这些结构和细胞研究揭示了一种基于蛋白质动态的远端跨蛋白质复合物重新分配构象熵的变构机制,该机制不受肌动蛋白-细胞骨架力的影响,并决定自分泌和旁分泌TGF-β功能。这些结果进一步推进了TGF-β家族成员的潜伏和激活的机制理解,为通过柔性细胞表面蛋白的蛋白质动态来理解信号传递的结构理解提供了路线图。
相关News
- 英矽智能携手海正药业,8个月完成临床前候选化合物提名 2026-01-04
- DLL3靶点再现重磅BD 泽璟制药在研药物“卖”出超12亿美元 2026-01-04
- 荣昌生物「维迪西妥单抗」新适应症拟纳入突破性疗法 2026-01-04
- 兴盟生物首获国际GMP认证,创新单抗药物克瑞毕®加速走向全球 2026-01-04
- 诺和诺德、礼来争霸战火“东渐” 2026-01-04





