
印度作为世界第一的仿制药大国,在近5年内,其医药行业以13%-14%飞速增长。
大家想必对印度这个“开挂”的国度都有或多或少的关注,今天(敲黑板),小D来给大家讲讲,印度药品注册法规中,3个非常重要的“Form”。
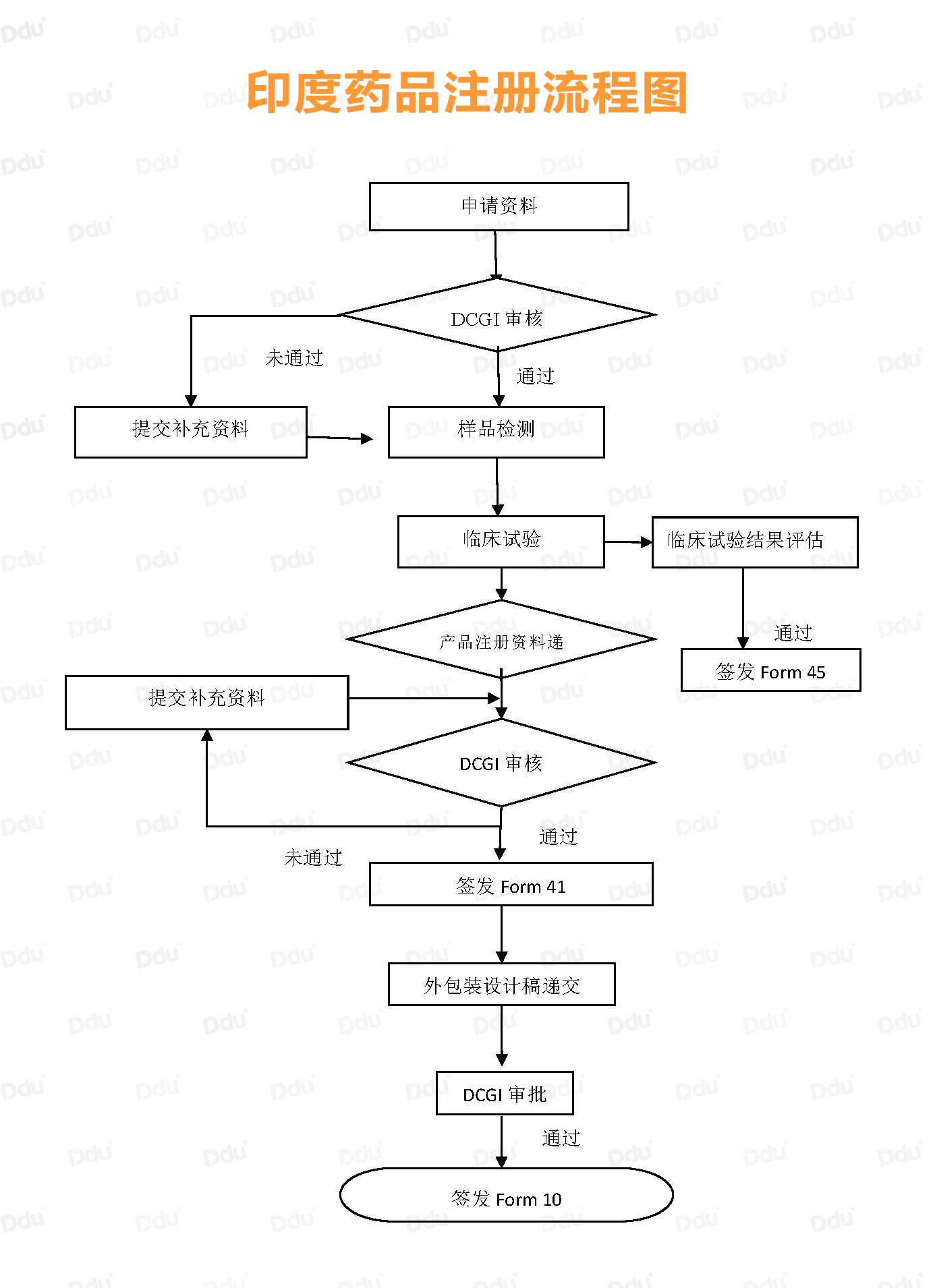
Form 45:Permission to Import Finished Formulation of New Drug
作为成品进入印度市场的第一道门槛,申请Form 45要求供应商提供PMF、SMF、CTD等包含GMP认证和产品注册等一系列的文件。
待DCGI(印度药监局)审核通过以后,就可以进入样品检测、临床试验阶段。
通常来说,样品检测数量要求为:连续三批全检数量。值得注意的是,样品检测所用产品批次需与临床试验的批次保持一致。
大家肯定有疑问,必须要在印度开展临床吗?需要开展几期临床?根据小D这么多年的经验来说,印度开展临床期数、例数,与现有临床情况以及是否有原研在当地上市有关。
以临床III期为例,试验人数一般300-500例,所需时间为一年半左右。如果样品检测合格,临床试验良好,那么,恭喜你拿到Form 45证书,成功向印度市场迈进了一大步,证书什么样?请见下方:

▲Form 45示例
Form 41:Registraion Certificate
完成Form 45的申请后,印度注册的进度条基本上能完成70%,毕竟样品检测和临床试验差不多能花掉2年的时间。
接下来是申请Form 41,也就是我们通常所说的药品注册证。申请文件要求基本上与Form 45一致,所以提醒大家:请记得准备两套资质性文件(如GMP证书、COPP证书、生产许可证书等)。
在审核资料的过程中,若有需要解释和补充的信息,DCGI会向申请者发资料补充函;若提供的补充资料不足,则有可能被驳回注册。印度DCGI将会根据所递交的资料和补充信息的审核结果做出最后评估,并颁发Form 41。

▲Form 41示例
Form 10:License to Import Drugs
Form 10即进口许可证,药品出口印度最重要的凭证之一。为什么这么说?因为该证书明确列出允许药品在印度上市的进口许可证编号。
当我们完成Form 41的申请后,需要向DCGI提供最终版的英文产品外包装设计稿(包括小盒、瓶签、说明书等)。
温馨提示:如果是疫苗产品,需保留中国药品电子监管码;且在小盒包装上要给印度进口许可证号留一席之地。
最终,若资料审核通过,印度DCGI将会颁发进口许可证书Form10。

▲Form 10示例
为了方便大家的理解,小D在这里给大家附送《印度药品注册流程图》:
本文由微信公众号:「Ddu滴度」(ddunews)原创,转载请注明出处。关注我们,每天早上可以准时获取更多实用医贸资讯。
相关News
- 【专家速答】FDA的药品审批流程是什么? 2023-07-27
- 【专家速答】药品注册的分类注册管理是什么样的? 2023-07-27
- 【专家速答】如何做好药品注册工作? 2023-03-24
- 滴度学院:印度注册——资料首次递交官方之后需要做什么? 2021-06-15
- 印度卫生部禁止了市场上电子烟IQOS的销售 2018-09-04

 6,765
6,765



