
相信了解印度注册的朋友们都知道,印度注册分为两步---Marketing Approval以及Product Registration。具体的流程大家可以在滴度网站上找到我们为大家整理的多个国家的注册简介和流程图。
今天小D要给大家重点讲述的是Marketing Approval的资料在首次递交官方之后我们还需要做些什么呢?
1.等待官方资料反馈,并根据反馈进行相应的资料修订和补充;
2.准备印度临床III期方案;
看到这里或许大家会有疑惑,为什么在注册的第一阶段,也就是Marketing Approval阶段我们就需要准备临床方案呢?
首先, 临床III期的研究是对于疫苗类产品要进入印度市场的大前提;
其次, 印度样检和临床III期资料的审核也是Marketing Approval阶段不可或缺的一部分资料,所以在市场准入许可发放之前,我们就得完成这个部分的试验。
3.临床III期方案及样品检验申请递交官方,等待获批;
4.III期方案和样检申请获批后,样品发至印度CRI KASAULI进行检测;
5.样检通过,在印度进行临床III期试验;
6.Marketing Approval阶段所有资料审核通过之后,我们将获得Form 45;
7.随后,我们准备递交Product Registration阶段的的相关资料并等待审核,通过后即可获得Form 41;
8.最后一步,提交产品包装材料并等待审核通过,获得Form 10,即可正式进行产品出口了。
P.S 关于第6-第8点Form的了解,请点击此处。
这里划重点:在什么时候准备印度临床III期方案比较合适呢?答案是---越早越好。究其原因,小D为大家展示一个流程图---
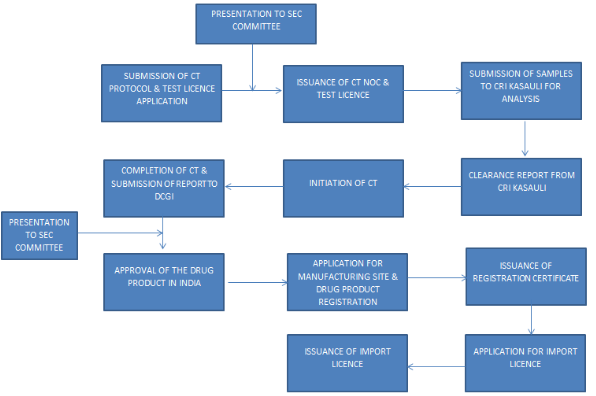
图中我们可以了解到,印度临床III期方案是与样检申请一起递交至官方的,并且在临床III期方案和样检申请同时获批后,方可将样品送至印度CRI KASAULI进行检测。而临床方案的拟定通常需要花费较长的时间,所以我们在正式确定合作之后,即可根据国内的临床方案初步拟定需要在印度开展的方案,在很大程度上可以缩短整个注册的耗时。
责编: Milo
相关News
- 印度卫生部禁止了市场上电子烟IQOS的销售 2018-09-04
- 限时免费:这里有11个国家的药品出口注册攻略! 2018-07-17
- 滴度学院:抢占印度药品市场,你必须知道的几个“Form” 2018-07-13
- 这些国家突然宣布限制进口!出口印度、俄罗斯、苏丹等国注意新规 2018-03-23
- 滴度在现场:直击2017年印度CPhI 2017-12-01

 2,507
2,507



