很多医贸人在刚接触原研药和仿制药时,都会问小D:仿制药与原研药含有相同的活性成分,看上去极其相似,真正的区别究竟在哪里?为什么原研药成本那么高?
今天,小D带你一起深入了解有关原研药和仿制药的那些事儿,那些你可能不知道的区别。
一、什么是原研药?

这是中国特有的一个概念。既不全指专利药,也涵盖了某些仿制药。
根据国家发改委规定,化合物专利过期(包括行政保护期结束)的专利药品和同类药品(未能申请中国专利保护,但在国内首次上市的药品,这就已经潜在涵盖仿制药)共同构成原研制类药品。
原研药是我国在2000年开始实行政府统一定价后才有的。提法设立原研制类药品,主要是为了鼓励研发新药,加强知识产权保护,保持药品合理比价,同时也是为了体现药品质量和疗效的差异。
这与中国的《药品注册管理办法》规定的化学药一类新药不是一个层次上的概念,涵盖面更广,关注点和侧重点不同。而在实际操作上,原研药即使在专利过期后,依然在中国享有“超国民”的待遇,不但享受定价权,即使在仿制药出现的情况下,也不会被限价,变相被保护起来,在与仿制药的市场竞争中处于绝对优势。
二、什么是仿制药?
仿制药是指与被仿制药在剂量、安全性和效力、质量、作用以及适应症上相同的一种仿制品。
原研药过了保护期,其他企业均可仿制,这类仿制的药品通常被称为仿制药。
美国FDA有关文件指出,能够获得FDA批准的仿制药必须满足以下条件:
1、和被仿制产品含有相同的活性成分,其中非活性成分可以不同;
2、和被仿制产品的适应症、剂型、规格、给药途径一致;
3、生物等效;
4、质量符合相同的要求;
5、生产的GMP标准和被仿制产品同样严格。
三、原研药和仿制药的区别
那么,两种看上去极其相似的药品,真正的区别究竟在哪里?

● 生产
相同点:仿制药是原研药主要成分的复制。
不同点:两者原料的纯度、其余成分的添加和制造工艺不同。以上三点不同将直接导致药物进入靶组织的程度和速度的不同。
● 安全性
原研药:由于试验检验和临床检验时间较长,保证其疗效及安全性。
仿制药:很大一部分实际效果、毒副反应的实践检验时间不长,病例有限,难以全面、准确地反映其实际性能。
● 价格差
原研药价格普遍比仿制药更高。我国《药品政府定价办法》第六条规定:区别GMP与非GMP药品、原研药品与仿制药品、新药和名优药品与普通药品定价,优质优价。
● 研发和批准
原研药比仿制药研发、批准都更复杂,需要消耗大量的时间和金钱,接下来小D将仔细讲讲这一部分。
四、原研药为什么成本高?
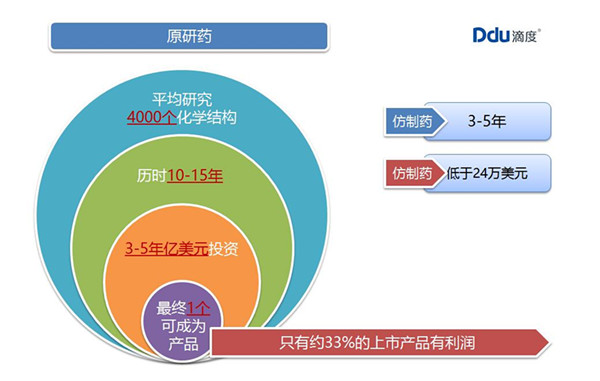
原研药的成本高,和它的研发上市流程脱不开关系。
按通常情况,原研药上市一般要经过以下阶段:
立项(4个月)——临床前研究(9-24个月)——临床研究申请(大于1年)——临床试验批件——临床研究(3-5年)——生产申请(1年-n年)——受理通知书后审核和现场考察——获批生产上市(约6个月)——监测期。
● 立项(特指原研药发现以后)
所需时间:4个月
主要进行一系列市场调研工作,通过对市场、流行病学、技术、疗效和安全、知识产权、成品成本、国家政策、企业自身条件等方面的考察,来确定研发品种和治疗某类疾病药物上市后的市场潜力,从而选择适合本企业的品种。
● 临床前研究
所需时间:9-24个月
有新药品进入人体临床研究之前,必须提供其安全性评估资料,主要包括研制情况、非临床动物试验数据,从而可以推衍出此药品实际产生的作用。这一阶段的研究主要是在动物身上进行的。
对于新药,其过程包括:小试产品→药效筛选→制备工艺优化数据→质量标准→中试放大→药理毒理→药剂工艺→稳定性实验→资料整理报批。
● 临床申请+临床试验批件
所需时间:1年以上
这期间可能需要反复递交补充资料,若申请通过,则会颁发临床试验批件,如申请不通过,则发不予受理通知书。
● 临床研究
所需时间:3-5年
临床研究分为I、II、III、IV 期:
I期:初步临床药理学评价及人体安全性评价,确定剂量,一般20-30例。
II期:治疗作用,初步评价,确定临床给药方案,大于100例。
III期:治疗作用确证,确定有效性和安全性,大于300例。
IV期:新药上市后申请人自主进行的应用研究,确定副作用,大于2000例。
● 新药监测期
新药生产申请获批后,就可以进行试生产,申报定价上市并进行销售, 但在上市后(有些药品FDA会要求进行临床IV期试验)会进入新药监测期。药品生产企业应当考察处于监测期内的新药的生产工艺、质量、稳定性、疗效及不良反应等情况,并每年向所在地省、自治区、直辖市药品监督管理部门报告。监测期自新药批准生产之日起计算,最长不得超过5年。
综上,原研药上市需要经历漫长的研发、临床和注册,整个流程耗时长、花费巨大。而且,研发出来的原研药还不一定有良好的药理作用,打水漂的可能性非常高。
五、仿制药的研发上市更简单
与原研药注册申报流程相比,仿制药的注册申报简单得多了,只要能按要求照着原研药成分做出来就能上市,不需要做大规模临床试验,申报时可以用走“简略新药申请”,标准相对宽松,前期耗费的时间和费用大概会省下三分之二。
但是关于原研药和仿制药的疗效,按照药典标准,国内已上市的仿制药质量基本上都是合格的,和原研药做到了化学等价,但尚未做到完全的生物等效和临床等效。
以“中美上海施贵宝制药有限公司生产的降糖药——二甲双胍”(商品名格华止,国产仿制药一般称二甲双胍)举例。虽然全国有上百家企业在仿制二甲双胍,但格华止在国内一年的销售额超过2亿美元,占中国整个二甲双胍市场的70%。这是因为国产的二甲双胍看上去虽然与原研药没什么差别,而且价格上也比原研药便宜很多,但临床上还是有不少患者要求使用原研药。
责编: Rihanna相关News
- 【专家速答】药品注册的分类注册管理是什么样的? 2023-07-27
- 滴度周报 | 国家卫健委最新通知:完善国家传染病医学中心设置;葡萄糖注射液等42个药品被注销 2021-06-21
- 滴度周报 | 价格公布:国产新冠疫苗来了;10省耗材谈判:国产仅6个产品中标 2020-08-24
- 硬核!瑞德西韦被仿制 2020-02-21
- 仿制就是为了替换原研!“一品两规”成一致性评价落地最大障碍 2018-06-25

 3,526
3,526



