mRNA CAR-T疗法 | 抗体偶联LNP(Ab-LNP)策略中如何选择T细胞靶向抗体
2024-09-04
来源: drugdu
 1,292
1,292
生物制品圈 2024年09月03日 09:20 湖北
以下文章来源于工程菌星球 ,作者倍增的耀菌君

工程菌星球.
微生物载体重组药物产业化;mRNA&circRNA&saRNA科研定制CRDMO;合成生物无菌医美生物制品;基因工程菌种相关内容分享。YHbio-Microbial CRDMO自媒体。
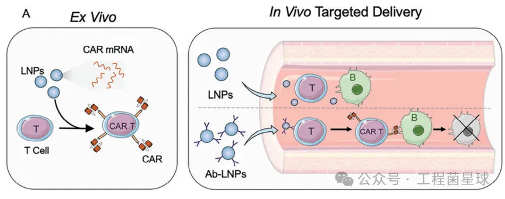
导读:当前,FDA批准了多款嵌合抗原受体(CAR)-T细胞疗法用于癌症免疫治疗。然而,基于病毒载体和体外细胞培养的生产技术导致了高生产成本和潜在的长期副作用。随着mRNA和脂质纳米颗粒(LNP)技术的发展,基于LNP这一非病毒载体实现CAR 的体内递送的设想有望实现。由于LNP的肝脏趋向性,mRNA-LNP介导的CAR-T疗法面临的首要挑战是:如何实现mRNA的T细胞靶向
使用抗体修饰LNP(也称为抗体偶联LNP, Ab-LNP)是一种有效的解决方案。那么,T细胞表面有哪些标志物,如何选择T细胞靶向的抗体呢?
菌菌查询到,宾夕法尼亚大学的Drew Weissman(诺奖得主)和Michael J. Mitchell课题组发表了多篇Ab-LNP靶向T细胞、并用于原位CAR-T疗法的概念性验证结果。菌菌在他们发表的文献中,查找到“靶向T细胞的抗体类型”,包括CD4抗体、CD3抗体、CD5抗体和CD7抗体。
01
CD4抗体LNP递送报告基因mRNA
题目:Highly efficient CD4+ T cell targeting and genetic recombination using engineered CD4+ cell-homing mRNA-LNPs
期刊:Molecular Therapy【影响因子12.1】
链接:pubmed.ncbi.nlm.nih.gov/34091054/
这篇文章由宾大Weissman与mRNA领头企业Acuitas Therapeutic合作发表。研究报道了将CD4抗体与LNP偶联可实现对CD4+细胞(包括T细胞)的特异性靶向和mRNA靶向递送,文中使用的mRNA编码荧光素酶(报告基因)和Cre重组酶。
研究人员在小鼠体内进行全身注射后,CD4靶向的放射性mRNA-LNP在脾脏中积累。与非靶向mRNA-LNP相比,从脾脏中分离的T细胞中报告基因mRNA的信号强度高出约30倍。向小鼠静脉注射装载有编码Cre重组酶的mRNA的CD4 Ab-LNPs后,可实现特异性的剂量依赖性loxP介导的遗传重组,脾脏和淋巴结中分别有约60%和40%的CD4+ T细胞表达报告基因。T细胞表型分析显示,T细胞亚群被均匀转染。
02
CD5抗体偶联LNP递送CAR mRNA
题目:CAR T cells produced in vivo to treat cardiac injury
期刊:Science【影响因子44.7】
链接:pubmed.ncbi.nlm.nih.gov/34990237/
这篇文章由宾大Weissman等多个课题组联合发表。研究报道了使用CD5抗体修饰的LNP成功将CAR mRNA递送至小鼠T细胞,并产生了有效的CAR-T细胞。其中CAR mRNA序列包含小鼠成纤维细胞活化蛋白(FAP)特异性单克隆抗体的scFv片段。
研究人员在心力衰竭小鼠模型中注射靶向CD5的LNP mRNA,评估了体内CAR-T细胞疗法的疗效。实验观察到,Ab-LNP成功将CAR mRNA高效地递送到T淋巴细胞中,在体内产生了瞬时且有效的CAR-T细胞。
这项研究的突破性在于,研究人员构建了一种体内CAR-T平台,无需将细胞从患者体内分离即可针对性诱导CAR-T细胞的体内生产,并且能够应用于不同疾病。
03
CD3/CD5/CD7抗体偶联LNP递送CAR mRNA
题目:In Vivo mRNA CAR T Cell Engineering via Targeted Ionizable Lipid Nanoparticles with Extrahepatic Tropism
期刊:Small【影响因子13】
链接:pubmed.ncbi.nlm.nih.gov/38072809/
这项研究由宾大Michael J Mitchell和Weissman合作发表,Michael J Mitchell作为通讯作者。
作者在研究背景中提到,T细胞标志物包括:CD3、CD8、CD4、CD7、CD5、Nrp1和β7等。其中CD4和CD8是T细胞亚群的标志物,这些细胞可能不利于CAR-T细胞免疫治疗等应用。而CD3、CD5和CD7是泛T细胞标志物,更适合用于CAR-T疗法。因此,研究者使用了3种抗体修饰LNP,用来递送CD19靶向的CAR mRNA。
小鼠体内实验结果显示,靶向CD3和CD7的两种Ab-LNP平台递送CAR mRNA可获得显著的CAR阳性细胞,并伴有有效的B细胞耗竭。因此,作者认为这两种Ab-LNPs是在体内生产功能性CAR T细胞的一种手段,可以开发应用于CAR T细胞工程和其他T细胞工程平台。
04
总结
当前获批上市的CAR-T细胞疗法是一种体外T细胞编程,在治疗血液系统恶性肿瘤方面取得了显著的成功。但CAR-T细胞的制作过程复杂且成本高昂。因此,mRNA-LNP介导的体内原位CAR-T疗法的开发至关重要。
以宾夕法尼亚大学的Drew Weissman和Michael J. Mitchell为代表的研发团队,创新性地开发了抗体修饰LNP(Ab-LNP)的策略,将CAR mRNA靶向T细胞完成了原位CAR-T疗法的概念性验证。
通过定制化的CAR mRNA,如肿瘤杀伤分子CD19、心衰标志物成纤维细胞活化蛋白(FAP)等,原位CAR-T平台有望应用于各种疾病的治疗。
相关News
- 上海医药利伐沙班片获得新加坡药品注册证书 2026-02-27
- 针对初治NSCLC!勃林格殷格翰「宗艾替尼」获得FDA特批 2026-02-27
- 三生国健:重组抗IL-4Rα人源化单克隆抗体注射液上市申请获受理 2026-02-27
- 智翔金泰泰利奇拜单抗注射液成人季节性过敏性鼻炎适应症上市申请获受理 2026-02-27
- 138亿!国产影像设备龙头业绩大增 2026-02-27





