2017年6月,巴基斯坦药品监管机构DRAP(Drug Regulatory Authority of Pakistan)颁布一条新规《Statutory Notifications (S.R.O) 470 (I)/2017》,要求药品在6个月内实现序列化和条形码系统。
据全球跨境医贸B2B电子商务平台滴度(www.drugdu.com)了解,新规适用于所有进出口或巴基斯坦国内生产的常规药品,包括人用和兽用生物制剂,暂不适用于替代药物、健康或非处方药品、营养品、医疗设备、医用气体或放射性药物。

新规是巴基斯坦政府为打击假药而采取的一系列举措之一。根据新规,所有药品必须在6个月内,添加机器可读的条码标签,条码标签要求适用于产品跟踪追踪系统。根据这项新规,如果进口药品在进口时不符合规定,药品进口商必须在当地有资质生产药品或者销售药品的厂商补印上相关信息之后,才能进入巴基斯坦市场。
机器可读的二维条码必须基于GS1嵌入式产品标识码的标准,也称为全球贸易项目编号(GTIN),这是一个由14个字符组成的唯一标识码。二维条码还必须包括有效期限、批号、产品标识信息(包括药品名称、剂量和包装尺寸)和序列号。二维条码需要包括的内容如下图所示:
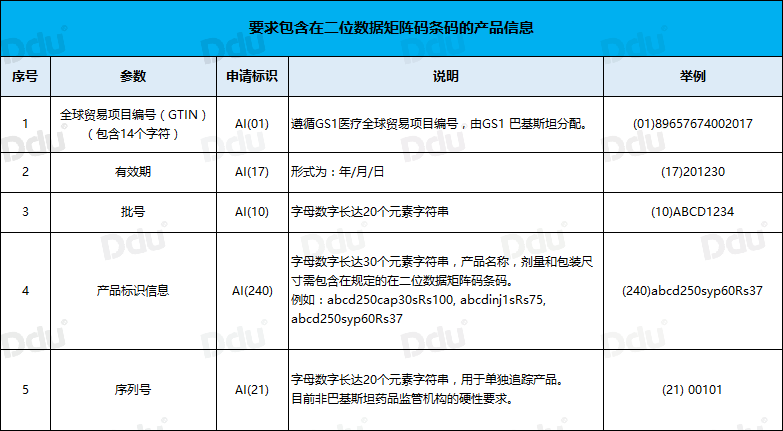
药品制造商需要将产品和公司信息直接提交给由DRAP协调的DRIS(药品监管信息系统)在线数据库,同时还需要维护自己的产品条形码信息数据库。DRAP也在按照国际惯例开发完整的跟踪追踪系统。
继2016年底颁布相关法令要求药品注册文件以CTD格式递交后,巴基斯坦又快速颁布这样的新规,可见巴基斯坦药物监管机构紧跟欧美规范市场步伐的决心。巴基斯坦国家卫生服务部长Saira Afzal Tarar称此新规将大力推动消灭假冒伪劣药物。
针对这项新规,也有一些不同的声音。巴基斯坦药品制造商协会前主席哈西•卡西姆(Haroon Qassim)说:“巴基斯坦药物管理局计划采用序列化很有想法,但是也比较激进,这个过程比美国和欧洲快得多。”巴基斯坦药品制造商协会(PPMA)已经敦促DRAP重新考虑,声称六个月的时间实在太紧了。在这项规定的要求下,巴基斯坦药品生产企业或者药品进口商需要投资新技术,进行重大的流程变更,并可能要重组供应链。
另一位前巴基斯坦药品制造商协会主席Jawed Akhai表示,巴基斯坦药物管理局规定的实现序列化和条形码系统留下的六个月时间不够,只有多年来一直致力于应用这些技术的公司有可能在规定期限内满足要求。
责编: Daisy
相关News
- 【专家速答】国内三类医疗器械想出口巴基斯坦,需要哪些手续,注册流程和周期是怎样的? 2023-04-18
- 越南河内医疗器械展览会 vietnam medipharm 2023-03-29
- 巴西圣保罗医疗展览会 HOSPITALAR 2023-03-23
- 世界制药原料中国展览会CPhI China 2022-02-22
- 2021年巴基斯坦(亚洲)国际医药展 Pharma Asia 2021-09-17
您已成功订阅,无需重复提交。
确认
邮件订阅
请输入正确邮箱!
订阅
邮件订阅热门医贸资讯,了解第一手信息。
行业动态更多
-
出海制药企业能力账本:生产、分析、制剂,买家真正关心什么?
2026-02-11 -
苑东生物EP-0210单抗注射液I期临床试验完成首例受试者给药
2026-02-10 -
智飞生物:重组带状疱疹ZFA01佐剂疫苗(CHO细胞)临床试验获批
2026-02-10

 2,727
2,727



