EMBO J丨解云礼团队揭示胶质细胞异质性机制
2024-09-24
来源: drugdu
 401
401
BioArt BioArt
在哺乳动物的大脑中,除了大量的神经元之外,还存在着数量庞大的胶质细胞。这些胶质细胞广泛参与了大脑高级功能的各个方面。其中,星形胶质细胞作为哺乳动物大脑中数量最多的胶质细胞之一,在大脑的功能行使中发挥着至关重要的作用,涵盖参与突触修剪、血脑屏障的形成以及调节大脑内稳态平衡等。并且,越来越多的研究表明,星形胶质细胞直接参与神经环路信息的处理,而其发育障碍可能引发多种脑疾病。值得注意的是,星形胶质细胞的形态和转录组特征在不同脑区乃至同一脑区都呈现出高度的异质性。在大脑发育过程中,星形胶质细胞的起源,即神经干细胞的位置,决定了星形胶质细胞在大脑中的分布,这被视为星形胶质细胞异质性产生的原因之一。然而,目前在大脑发育过程中,关于星形胶质细胞在大脑中的分布是如何被调控的机制尚不明确。
近日,复旦大学脑科学研究院的解云礼团队在The EMBO journal发表了题为 Astrocyte allocation during brain development is controlled by Tcf4-mediated fate restriction 的文章。该研究揭示,转录因子 Tcf4 通过对腹侧大脑神经干细胞来源的少突胶质细胞前体细胞的命运进行限制,抑制星形胶质细胞的命运,从而精准调控星形胶质细胞在背侧新皮层的定位。

实验室的前期研究表明,胚胎期神经前体细胞在皮质中的精确定位对皮层发育起着重要作用【1】,凸显了胚胎期神经前体细胞空间位置在脑发育中的重要性。转录因子 TCF4 突变可导致自闭症谱系皮特霍普金斯综合征,患者常伴有智力低下、发育障碍、语言发育迟缓等症状。解云礼团队前期研究发现,TCF4 对兴奋性神经元在皮层中的定位维持至关重要。TCF4 缺失型小鼠皮层神经元呈簇分布【2】,这与早期发现的部分自闭症患者儿童皮层存在神经元成簇现象一致【3】。同时,TCF4还参与海马神经元的迁移【4】。基于前期研究中发现的 TCF4 调控嗅球少突胶质细胞数量控制这一成果【5】,团队利用小鼠模型,结合Cut-Tag,单细胞测序和ATAC-seq等组学技术,发现 TCF4 能够抑制少突胶质细胞中星形胶质细胞基因的表达,实现腹侧端脑来源的胶质细胞命运限定在少突胶质细胞,避免了腹侧端脑来源的星形胶质细胞分布在背侧新皮层。通过结合组织透明化技术和星形胶质细胞钙成像技术,发现腹侧端脑起源的星形胶质细胞的特征与背侧神经干细胞产生的星形胶质细胞更为类似,但却与同源的腹侧星形胶质细胞有所区别。这些结果提示腹侧端脑来源的星形胶质细胞受到背侧皮质环境的影响,暗示星形胶质细胞具有一定的可塑性。
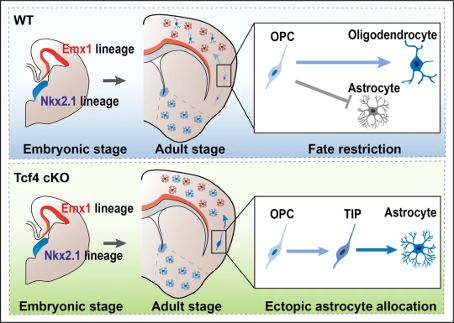 皮特霍普金斯综合征是由转录因子 TCF4 突变导致的一类自闭症谱系罕见病。尽管临床研究表明是由于 TCF4 突变所致,但致病机理尚不清楚。以往的研究,包括解云礼团队的研究,多集中在 TCF4 在神经元中的作用。而这项工作首次发现 TCF4 对胶质细胞发育的调控作用,为理解皮特霍普金斯综合征的发病机理提供了新的思路。
皮特霍普金斯综合征是由转录因子 TCF4 突变导致的一类自闭症谱系罕见病。尽管临床研究表明是由于 TCF4 突变所致,但致病机理尚不清楚。以往的研究,包括解云礼团队的研究,多集中在 TCF4 在神经元中的作用。而这项工作首次发现 TCF4 对胶质细胞发育的调控作用,为理解皮特霍普金斯综合征的发病机理提供了新的思路。
复旦大学脑科学研究院的解云礼研究院为该论文的通讯作者,解云礼课题组的张燕东、李丹和蔡玉群为共同第一作者。实验室其他成员和合作者也在课题开展过程中做出了重要贡献。
相关News
- 苑东生物EP-0210单抗注射液I期临床试验完成首例受试者给药 2026-02-10
- 智飞生物:重组带状疱疹ZFA01佐剂疫苗(CHO细胞)临床试验获批 2026-02-10
- 和誉医药FGFR4抑制剂依帕戈替尼获FDA快速通道资格,用于经ICI和mTKI治疗且FGF19过表达的晚期HCC患者 2026-02-10
- 赛诺菲「Rilzabrutinib」获美国突破疗法 + 日本孤儿药,中国已申请上市 2026-02-10
- 国产重磅 ADC 新适应症获批上市 2026-02-10
您已成功订阅,无需重复提交。
确认
邮件订阅
请输入正确邮箱!
订阅
邮件订阅热门医贸资讯,了解第一手信息。
行业动态更多
-
苑东生物EP-0210单抗注射液I期临床试验完成首例受试者给药
2026-02-10 -
智飞生物:重组带状疱疹ZFA01佐剂疫苗(CHO细胞)临床试验获批
2026-02-10 -
赛诺菲「Rilzabrutinib」获美国突破疗法 + 日本孤儿药,中国已申请上市
2026-02-10





