Edwards首次接受经导管三尖瓣置换治疗获得FDA批准
2024-02-04
来源: drugdu
 244
244
简讯一览
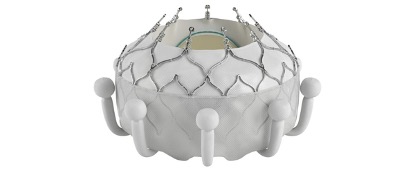
Edwards Lifesciences的Evoque三尖瓣置换系统获得了美国食品药品监督管理局的批准,成为第一家将经导管治疗三尖瓣反流的公司。
三尖瓣反流是指右心室之间的瓣膜无法正常关闭,导致血液向后泄漏。Edwards的Evoque设备是通过微创手术插入的,旨在取代三尖瓣。
竞争对手雅培公司已向美国食品药品监督管理局提交了一种名为TriClip的设备,该设备将三尖瓣的一部分小叶夹在一起,以防止血液回流。美国食品药品监督管理局计划于2月13日召开一个咨询小组讨论该设备。
事件洞悉
加拿大皇家银行资本市场分析师Shagun Singh在一份研究报告中写道,对Evoque的批准是“对Edwards和行业都有意义的里程碑”。
辛格写道,美国食品药品监督管理局的批准比预期的要早,爱德华兹预计将在2024年年中做出决定。这是基于Edwards的Triscend II关键试验的结果,该试验发现98.8%的患者在6个月后出现中度或较低的三尖瓣反流,30天后不良事件发生率为27.4%。
Edwards于周五宣布获得美国食品药品监督管理局的批准,并于10月获得了该设备的CE标志。
辛格预计,考虑到不同的疾病病因和患者解剖结构,以及缺乏平行的手术池,该设备的采用将比经导管主动脉瓣置换术更为缓慢。
辛格写道:“我们的检查还表明,随着更多临床证据的建立,以及医生评估哪些患者最适合这种疗法,这一领域还处于早期阶段。也就是说,这是一个服务严重不足的人群,因为大多数三尖瓣病患者目前几乎没有治疗选择。”
目前,三尖瓣修复通常通过心脏直视手术或使用药物来控制症状。Edwards的设备适用于有症状的严重三尖瓣反流患者,尽管有药物治疗。
其他微创治疗也在酝酿之中。BTIG分析师Marie Thibault预计,鉴于其Triluminate关键研究的积极安全性和有效性数据,Abbott的TriClip G4将获得批准。
Thibault在一份研究报告中写道:“我们不确定为什么要为TriClip召集一个FDA小组,但Evoque是在没有小组的情况下获得批准的。”
Edwards的Evoque系统是其经导管二尖瓣和三尖瓣治疗部门的一部分,该部门在第三季度实现了5200万美元的销售额。
来源:
https://www.medtechdive.com/news/edwards-fda-approval-evoque-tricuspid-valve/706429/
相关News
- 精神分裂症治疗70年重大突破!创新药物凯捷乐®中国获批 2025-12-26
- 血霁生物完成过亿元B1轮股权融资首关和过亿元债权融资 2025-12-26
- 仅需 1 分钟!罗氏双抗皮下注射剂型获 FDA 批准上市 2025-12-26
- 辉瑞败走血友病 2025-12-26
- 迈威生物单抗新药获FDA批准开展2a期临床,针对慢阻肺 2025-12-26




