CDK9抑制剂研发进展几何?AZ、拜耳、石药…
2023-04-04
来源: drugdu
 667
667

细胞周期是细胞生命活动的基本过程,控制着细胞从静止期转向生长增殖期。细胞周期蛋白依赖性激酶(CDKs)和细胞周期蛋白(Cyclins)是整个细胞周期调控机制中的核心分子。
CDKs是一组丝氨酸/苏氨酸蛋白激酶,和cyclin相互作用,共同调控细胞周期和转录,目前已发现近20个CDKs。
根据功能,CDKs可分为两大类:一类CDKs参与细胞周期调控,抑制增殖,主要包括CDK1、CDK2、CDK4、CDK6等;另一类CDKs参与转录调节,主要包括CDK7、CDK8、CDK9、CDK10、CDK11等。
CDK9在RNA转录中起关键作用,是阳性转录延伸因子b(P-TEFb)的一个亚基,可以磷酸化RNA聚合酶Ⅱ(PolII)阴性延伸因子(NELF)、DRB敏感性诱导因子(DSIF),以及RNA聚合酶Ⅱ的C末端结构域中的Ser2残基,最终触发RNA延伸。
CDK9激活引起的抗凋亡因子骨髓细胞白血病1(MCL-1)的过度表达将导致恶性肿瘤细胞转化,因此抑制CDK9将下调MCL-1,从而抑制肿瘤生长。
CDK9抑制剂研发进展几何?
CDK9抑制剂是继CDK4/6抑制剂之后又一潜力抗肿瘤药物研发方向。目前,全球已有多款CDK9抑制剂进入临床试验阶段,详见下表。其中AZD-4573、KB-0742等已进入2期临床,AZD-4573是阿斯利康从Probiodrug引进的一款CDK9抑制剂,静脉注射使用,适应症主要包括血液系统恶性肿瘤、弥漫性大B细胞淋巴瘤和套细胞淋巴瘤等。
全球部分已进入临床试验阶段的CDK9抑制剂
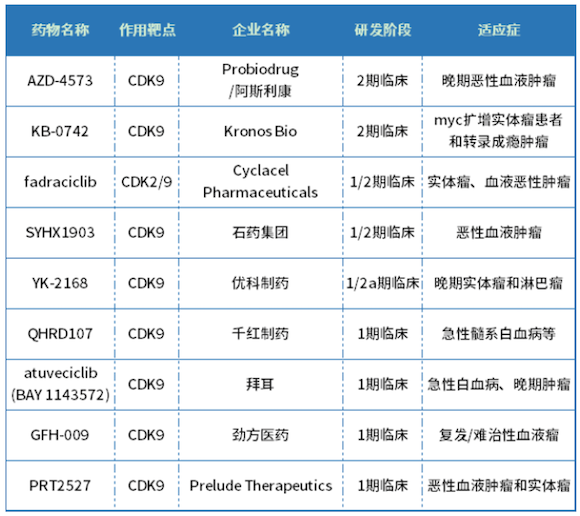
资料来源:药智数据、公开资料
KB-0742是一款高选择性的CDK9抑制剂,通过抑制CDK9的活性,可以降低致癌基因MYC的表达,目前在1/2期临床试验中用于治疗携带MYC扩增的实体瘤患者。
2021年11月公布的其针对实体瘤的初步数据显示,KB-0742具有较长的血浆半衰期,并且表现出剂量依赖性靶点抑制活性。
处于1/2期临床的fadraciclib是一种高选择性、强效、口服和静脉注射的CDK2/9抑制剂。临床前数据表明,fadraciclib可能使患有某些周期蛋白E成瘾或MYC扩增的实体瘤的患者受益,包括某些形式的乳腺癌、神经母细胞瘤、卵巢癌、子宫浆液性癌以及成人和儿童血液系统恶性肿瘤,如ALL、AML、B细胞淋巴瘤和多发性骨髓瘤。
2022年10月公布的fadraciclib口服治疗晚期实体瘤和淋巴瘤的1/2期临床研究数据显示:在可评估反应的18名患者中,接受治疗的3名T细胞淋巴瘤患者中有2名获得了部分反应,15名患有各种实体瘤的患者中有11名获得了稳定的疾病,且未观察到剂量限制性毒性。
SYHX1903为一种高选择性的周期蛋白依赖的蛋白激酶9(CDK9)抑制剂,在以CDK9为靶点的恶性血液瘤和实体瘤治疗方面具有巨大的潜力。临床前研究显示,该产品通过高选择性抑制CDK9,对恶性血液瘤和实体瘤有显著药效,同时具有良好的安全性和药代动力学特点
处于1期临床的QHRD107是千红制药自主研发的一类口服CDK9抑制剂,已完成治疗AML的1期临床研究,并取得临床研究总结报告。
1期临床结果显示:QHRD107在AML患者中的安全性较好,总体风险可控,并表现出一定的抗白血病活性,部分AML患者可从单药治疗中获益。2023年3月,该药联合维奈克拉和/或阿扎胞苷治疗AML的2期临床试验申请在国内获批。
atuveciclib是首个进入临床开发的选择性口服CDK9抑制剂。在体外,atuveciclib表现出较低的CDK9抑制活性,对其他CDKs具有较高的选择性,并对多种肿瘤细胞株具有抗增殖活性。
此外,atuveciclib在各种异种移植瘤模型中口服给药后,在耐受剂量下显示了单药在体内的有效性。
1期临床研究中,atuveciclib显示出有限的治疗指数,主要不良事件是中性粒细胞减少,部分原因可能是由于每天口服atuveciclib也会永久性地抑制循环白细胞mcl-1,而引起中性粒细胞凋亡。
GFH009是国内首个步入临床试验的高选择性CDK9抑制剂,临床前实验数据表明,GFH009对CDK9蛋白的选择性抑制率超过其他CDK亚型100倍以上。临床前实验数据还显示GFH009与BCL-2抑制剂药物联用的潜在抗肿瘤药效。
体外、体内药效实验表明,GFH009能够显著抑制恶性血液瘤细胞系的增殖,降低荷瘤动物死亡率、显著延长模型动物的存活时间。
2022ASH年会上公布的1期临床试验结果显示:GFH009单药在1期剂量爬坡试验的受试者当中耐受性良好,并在复发/难治性淋巴瘤患者显示出初步临床疗效。
截至目前该试验(NCT04588922)中未出现剂量限制性毒性事件,并在多例不同组织类型的淋巴瘤患者中观察到疾病稳定。
国内药企积极布局
值得一提的是,我国药企也积极布局CDK9抑制剂领域,其中劲方医药于2022年4月,将其CDK9抑制剂GFH009注射剂在大中华区(包括中国大陆、香港、澳门、台湾)之外的全球开发和商业化权益授权给SELLAS生命科学集团。
除有潜力用于治疗肿瘤,研究发现CDK9还有望成为抗TNF抵抗性炎症性肠病的潜在靶标。
而这一设想的基础是:转录因子T-bet是肠道内一种关键的免疫细胞调节因子,可以促进Th1细胞分化,刺激IFN-γ和TNF-α的表达,进而激发并加剧肠道粘膜炎症。
而已知T-bet调控Th1细胞分化是通过其下游的CDK9发挥作用——T-bet在Th1基因的增强子区域促使P-TEFb复合物(由CDK9、细胞周期蛋白T1或T2共同构成)的募集,催化亚基CDK9通过促进RNA聚合酶II(RNApolII)末端结构域CTD上的Ser2发生磷酸化从而促进Th1基因的转录延伸。
由于T-bet作为一种转录因子,难以作为治疗疾病的直接靶标,靶向CDK9或许是治疗IBD的潜在策略。2022年6月,伦敦国王学院免疫学与微生物科学学院的OmerSOmer团队在CellMolGastroenterolHepatol上发表的研究也进一步证明了该设想。
总结
与目前竞争激烈的CDK4/6抑制剂相比,CDK9抑制剂进展缓慢,进展最快的药物也才处于2期临床。我国药企在CDK9抑制剂领域的潜力不可小觑,石药集团、千红制药、劲方医药、优科制药等企业的在研CDK9抑制剂已陆续进入临床试验阶段,且在这些药物在临床前研究中显示出明显的抗肿瘤活性和安全性。
文章转载于https://news.yaozh.com/archive/38928.html
责编: editor相关News
- 口服减重新星!恒瑞GLP-1R/GIPR激动剂Ⅱ期研究成功 2026-02-13
- 第一三共注射用德曲妥珠单抗新适应症在中国获突破性治疗认定,用于乳腺癌辅助治疗 2026-02-13
- 替尔泊肽单药治疗适应症获批 推动2型糖尿病管理范式升级 2026-02-13
- 口服胰岛素上市折戟 华润医药拟出售天麦生物 2026-02-13
- 翰宇药业醋酸格拉替雷注射液获得美国FDA批准 2026-02-13





